
![]()
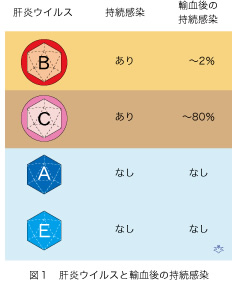 現在5種類の肝炎ウイルスが知られていて、それぞれAからEまでのアルファベットの大文字で区別されています。肝炎ウイルスは、ウイルスの構造と感染経路ならびに経過から二つに分類されます(図1)。B型肝炎ウイルス(HBV)とC型肝炎ウイルス(HCV)はウイルス本体を含む正二十面体の核(コアともいいます)が「ころも(エンベロープ)」に包まれていて、ヒトに持続感染します。両者とも血液を介して感染しますので、輸血後肝炎の原因となります。成人の輸血によるHBV感染は殆どが一過性に終わり持続感染は数パーセントにしか起こりません。一方、輸血後のHCV感染は約80%が持続感染しますので結果は遙かに重大です。最新の献血スクリーニングによってすら、これらのウイルスによる輸血後感染を完全に防御することは困難です。しかも、輸血後HBV感染の方が輸血後HCV感染より予防することが難しいのです。なぜ輸血後HBV感染を完全に防ぐことが困難であるか、を理解して頂くことが今回の目的です。
現在5種類の肝炎ウイルスが知られていて、それぞれAからEまでのアルファベットの大文字で区別されています。肝炎ウイルスは、ウイルスの構造と感染経路ならびに経過から二つに分類されます(図1)。B型肝炎ウイルス(HBV)とC型肝炎ウイルス(HCV)はウイルス本体を含む正二十面体の核(コアともいいます)が「ころも(エンベロープ)」に包まれていて、ヒトに持続感染します。両者とも血液を介して感染しますので、輸血後肝炎の原因となります。成人の輸血によるHBV感染は殆どが一過性に終わり持続感染は数パーセントにしか起こりません。一方、輸血後のHCV感染は約80%が持続感染しますので結果は遙かに重大です。最新の献血スクリーニングによってすら、これらのウイルスによる輸血後感染を完全に防御することは困難です。しかも、輸血後HBV感染の方が輸血後HCV感染より予防することが難しいのです。なぜ輸血後HBV感染を完全に防ぐことが困難であるか、を理解して頂くことが今回の目的です。
一方、A型肝炎ウイルスとE型肝炎ウイルスにはエンベロープがなく、感染者(又は感染動物)の糞便を介して経口感染しますが、持続感染しないので輸血によって感染することはきわめて稀です。従って、これらウイルスの献血スクリーニングは行われていません。D型肝炎ウイルスはHBVが一緒に存在しないと感染できない不完全ウイルスで、日本にはごく稀にしかいませんし、「ころも」が同じですのでHBVのスクリーニングを行えば、同時に輸血後感染を予防することが出来ます。
輸血後肝炎ウイルス感染征圧への道:目標ゼロ(Target Zero)
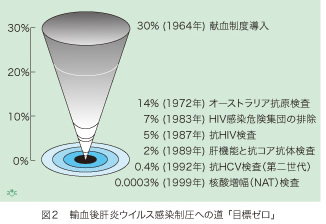 1964年に献血制度が導入される以前には、輸血後に肝炎ウイルス感染が30%以上も発症しました。売血を繰り返す人々の中に肝炎ウイルス感染が蔓延していることが分かり、売血を廃止し献血だけに限ることによって輸血後肝炎がかなり減少しました。1970年代初めにHBVのエンベロープである「オーストラリア抗原」のスクリーニングが開始されて以来は、医学のたゆまぬ進歩によって、過去35年の間に輸血後肝炎の頻度は限りなくゼロに近づいています(図2)。肝炎ウイルス感染の頻度が高い、HIVに感染する機会が多い人々からの献血を禁止し、1987年にはHIV抗体スクリーニングが開始されました。1989年以来は肝機能検査(ALT [GPTとも云います] が60単位/mL以上を排除)とHBVのコア抗体検査の導入によって輸血後肝炎は更に減少し、1992年に第二世代のHCV抗体検査が始められた時点では、既に0.4%にまで減少していました。
1964年に献血制度が導入される以前には、輸血後に肝炎ウイルス感染が30%以上も発症しました。売血を繰り返す人々の中に肝炎ウイルス感染が蔓延していることが分かり、売血を廃止し献血だけに限ることによって輸血後肝炎がかなり減少しました。1970年代初めにHBVのエンベロープである「オーストラリア抗原」のスクリーニングが開始されて以来は、医学のたゆまぬ進歩によって、過去35年の間に輸血後肝炎の頻度は限りなくゼロに近づいています(図2)。肝炎ウイルス感染の頻度が高い、HIVに感染する機会が多い人々からの献血を禁止し、1987年にはHIV抗体スクリーニングが開始されました。1989年以来は肝機能検査(ALT [GPTとも云います] が60単位/mL以上を排除)とHBVのコア抗体検査の導入によって輸血後肝炎は更に減少し、1992年に第二世代のHCV抗体検査が始められた時点では、既に0.4%にまで減少していました。
1999年にHBV、HCVとHIVの本体である核酸を増幅する核酸増幅検査(Nucleic Acid Amplification Test [NAT])が、世界に先駆けて日本で開始されました。NAT陽性の血液を排除することによって、これら3種類のウイルスによる輸血後感染が更に減少しました。日本では年間約600万単位の献血があり、大多数の献血者は過去に何回も献血した経験がありますので、持続性肝炎ウイルス感染がないことを確かめられています。患者さんは平均して献血者4人からの輸血(全血あるいは血液成分)を受けますので、輸血の年間総数は約150万回となります。NATが開始されてから、輸血によるHCV感染とHIV感染は数例だけしか起こっていません。しかし、輸血によるHBV感染は数十万分の一の頻度で起こり、年間に2〜3例も発症しています。
なぜ輸血後のHBV感染だけが防ぎにくいのでしょうか?
HBV感染を成立させるに必要なウイルス数(最小感染単位)
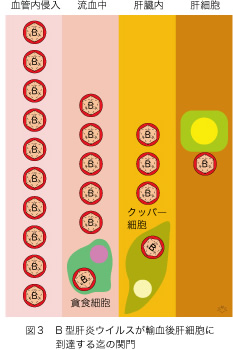 たった一つの肝細胞にHBVが唯一個到達すれば、それが次第に増殖し、やがては肝臓全体が感染します。ですから、理論的なHBVの「最小感染単位」は1個となります。しかし、HBVが輸血によって血管内に侵入してから肝細胞にたどり着くまでにいくつかの関門があります(図3)。血液中にある白血球の中には微生物などの外敵を飲み込んで体を守る機能をもつ貪食細胞(マクロファージと呼ばれています)が含まれています。それによって、HBVの大半は排除されます。肝臓に到達できても、小血管の壁には沢山の(数として肝細胞の15%もあります)クッパー細胞(1876年にドイツ人Kupfferが発見しました)が外敵を求めて徘徊しています。そこで更にHBVの数が減少します。
たった一つの肝細胞にHBVが唯一個到達すれば、それが次第に増殖し、やがては肝臓全体が感染します。ですから、理論的なHBVの「最小感染単位」は1個となります。しかし、HBVが輸血によって血管内に侵入してから肝細胞にたどり着くまでにいくつかの関門があります(図3)。血液中にある白血球の中には微生物などの外敵を飲み込んで体を守る機能をもつ貪食細胞(マクロファージと呼ばれています)が含まれています。それによって、HBVの大半は排除されます。肝臓に到達できても、小血管の壁には沢山の(数として肝細胞の15%もあります)クッパー細胞(1876年にドイツ人Kupfferが発見しました)が外敵を求めて徘徊しています。そこで更にHBVの数が減少します。
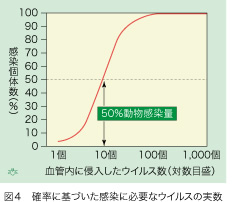 ですから、感染が成立するためには複数個のHBVが血管内に侵入する必要があります。一体、何個あれば感染するのでしょうか? HBVに感受性がある、チンパンジーでの感染実験から、血管内に注射したHBVと感染成立率の関係が明らかになってきました(図4)。横軸のウイルス数を対数目盛にしますと、ある範囲内で、注射したHBV数と感染率の間に直線関係があります。全体としてはS字型をしていますから、例えHBVが1個だけ体内に侵入しても100回に1回くらいの低い確率で感染が成立する可能性があります。また、100個あるいはそれ以上のHBVが血管内に入っても、貪食細胞とクッパー細胞がその全てを平らげてしまえば、肝細胞には一個も到着しないことがあるかも知れません。科学的には、HBVを注射されたチンパンジーの50%が感染するHBVの数で、感染に必要なウイルス数が推計学的に規定されています。大雑把な見積もりになりますがHBVが10個体内に侵入すれば50%の確率で感染が成立する、と考えて良さそうです。
ですから、感染が成立するためには複数個のHBVが血管内に侵入する必要があります。一体、何個あれば感染するのでしょうか? HBVに感受性がある、チンパンジーでの感染実験から、血管内に注射したHBVと感染成立率の関係が明らかになってきました(図4)。横軸のウイルス数を対数目盛にしますと、ある範囲内で、注射したHBV数と感染率の間に直線関係があります。全体としてはS字型をしていますから、例えHBVが1個だけ体内に侵入しても100回に1回くらいの低い確率で感染が成立する可能性があります。また、100個あるいはそれ以上のHBVが血管内に入っても、貪食細胞とクッパー細胞がその全てを平らげてしまえば、肝細胞には一個も到着しないことがあるかも知れません。科学的には、HBVを注射されたチンパンジーの50%が感染するHBVの数で、感染に必要なウイルス数が推計学的に規定されています。大雑把な見積もりになりますがHBVが10個体内に侵入すれば50%の確率で感染が成立する、と考えて良さそうです。
感染成立後HBVの動向
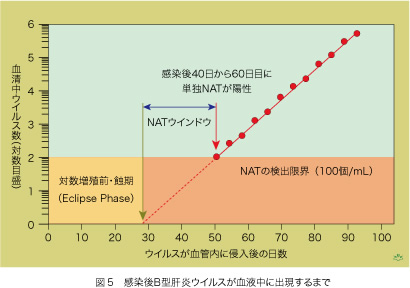 感染最小単位である10個ないし数10個のHBVが体内に侵入して感染が成立しても現行のNATスクリーニングによって直ちに感染を診断できるわけではありません。NATの検出限界(感度)は100個/mLですので、肝臓でHBVが増殖して流血中に放出され、血清1ミリリットル(mL)あたりのHBV数が100個以上になることが必要です。HBVが血中に姿を現してから一定期間は対数的に増加しますので(2倍、4倍、8倍、16倍という増え方をします)、HBV数を対数目盛にとると、経過日数との間に直線関係が成立します(図5)。
感染最小単位である10個ないし数10個のHBVが体内に侵入して感染が成立しても現行のNATスクリーニングによって直ちに感染を診断できるわけではありません。NATの検出限界(感度)は100個/mLですので、肝臓でHBVが増殖して流血中に放出され、血清1ミリリットル(mL)あたりのHBV数が100個以上になることが必要です。HBVが血中に姿を現してから一定期間は対数的に増加しますので(2倍、4倍、8倍、16倍という増え方をします)、HBV数を対数目盛にとると、経過日数との間に直線関係が成立します(図5)。
HBVに感染しても、その直後からHBVが血液中に姿を現すわけではありません。肝臓には1兆個もの肝細胞があって、血中に現れたHBVを即座に細胞表面にある受容体(レセプター)で細胞内に取り込んでしまいます。かなりの肝細胞にHBVが行き渡ってから始めて、血中にHBVが循環することになります。HBVの血中濃度が100個/mLに達する以前にも対数的に増加していると仮定して、HBVの実測直線を逆にたどって点線上に延長すると感染後約30日で、ようやくHBVが血中に現れることが推測できます。ウイルスが血液中に現れ、以後対数的に増加するまでの期間は、肝臓にHBVがいても血中に姿を見せませんので日蝕にたとえて蝕期(Eclipse Phase)と呼ばれています。感染以後この蝕期にある献血者の血液には輸血してもHBV感染性がないだろう、と推測できます。HBVが血中に出現し血液に感染性があっても、それから約20日(感染後約50日になります)経過しないと、NATで検出できる100個/mLの濃度に達しないことが分かります。感染性があっても、NATスクリーニングでHBV陽性血液を検出できないこの期間を、外敵が侵入してしまう開いた窓(window)にたとえて、「NATウインドウ」と云っています。
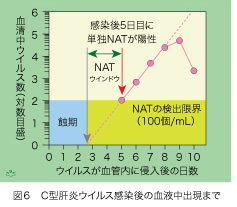 HBVの増殖速度は、血清中でのウイルス数が2倍になるのに必要な時間で表現され、いくつかの報告がありますが、2.6日(62時間)に一致しています。NATウインドウはウイルスの2倍増殖期間が長いほど延長します。同様に輸血により伝搬するHCV感染後の動態と比べてみましょう。HCV最小感染単位(約10個)をチンパンジーに接種した後、すぐにはウイルスが血液中に出現しません(図6)。実測できる直線的な増殖期間を点線でさかのぼりますと、HCVは感染後3日以内に血液中に出現し、5日目にはNATで検出できる100個/mLの濃度に到達します。ですからHCVのNATウインドウは僅かに2、3日間だけで、HBVの20日間とくらべると、10分の1以下に過ぎません。HCVの2倍増殖時間は約6時間で、HBVの62時間と比べて、やはり10分の1程度です。HIVの2倍増殖時間も10時間程ですから、感染後の血中動態はHCVに近く、NATウインドウも数日以内であろうと考えられます。倍増速度の大きな違いから、NATスクリーニングによって輸血後HCVとHIVの感染は効率的に予防できますが、輸血後HBV感染を防ぐことは、それより遙かに困難であることが、ご理解頂けましたでしょうか。
HBVの増殖速度は、血清中でのウイルス数が2倍になるのに必要な時間で表現され、いくつかの報告がありますが、2.6日(62時間)に一致しています。NATウインドウはウイルスの2倍増殖期間が長いほど延長します。同様に輸血により伝搬するHCV感染後の動態と比べてみましょう。HCV最小感染単位(約10個)をチンパンジーに接種した後、すぐにはウイルスが血液中に出現しません(図6)。実測できる直線的な増殖期間を点線でさかのぼりますと、HCVは感染後3日以内に血液中に出現し、5日目にはNATで検出できる100個/mLの濃度に到達します。ですからHCVのNATウインドウは僅かに2、3日間だけで、HBVの20日間とくらべると、10分の1以下に過ぎません。HCVの2倍増殖時間は約6時間で、HBVの62時間と比べて、やはり10分の1程度です。HIVの2倍増殖時間も10時間程ですから、感染後の血中動態はHCVに近く、NATウインドウも数日以内であろうと考えられます。倍増速度の大きな違いから、NATスクリーニングによって輸血後HCVとHIVの感染は効率的に予防できますが、輸血後HBV感染を防ぐことは、それより遙かに困難であることが、ご理解頂けましたでしょうか。
HBVコア抗体スクリーニングの偉大なる功績
1989年以来、日本赤十字社血液センターでHBVコア抗体のスクリーニングが開始され、NATが導入されるまでの10年間は、これが輸血後HBV感染の予防に絶大な効果を発揮しました。現在でも適用され、遠い過去にHBV感染を離脱した献血者の血液活用のためにも、大いに役立っています。
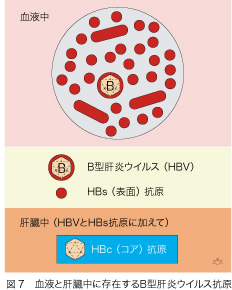 HBV感染者の血液中にはHBV本体ならびにそのエンベロープだけからできている小型球形粒子(棒状粒子も少しあって、数としてはHBVの千倍もあります)が含まれています(図7)。小型球形粒子は、以前オーストラリア抗原と呼ばれていましたが、のちにHBVの表面(surface [HBs])抗原であることが判明しました。肝臓の中には、これらに加えウイルスの核を構成するコア(core [HBc])抗原があります。感染が持続し、肝臓でコアが沢山作られている期間中は、これに対する抗体(HBc抗体)が産生されます。したがって、HBc抗体の力価を測定すれば、間接的に肝臓内のHBV増殖活動性を推測することができます。
HBV感染者の血液中にはHBV本体ならびにそのエンベロープだけからできている小型球形粒子(棒状粒子も少しあって、数としてはHBVの千倍もあります)が含まれています(図7)。小型球形粒子は、以前オーストラリア抗原と呼ばれていましたが、のちにHBVの表面(surface [HBs])抗原であることが判明しました。肝臓の中には、これらに加えウイルスの核を構成するコア(core [HBc])抗原があります。感染が持続し、肝臓でコアが沢山作られている期間中は、これに対する抗体(HBc抗体)が産生されます。したがって、HBc抗体の力価を測定すれば、間接的に肝臓内のHBV増殖活動性を推測することができます。
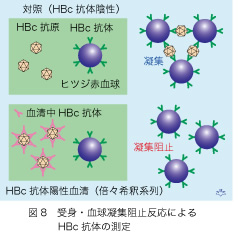 HBc抗体の力価測定は日本のお家芸で世界中でこれによる献血スクリーニングを施行している国は他にありません。開発当時から、簡単な受身血球凝集阻止反応でHBc抗体が測定されています(図8)。ヒツジ赤血球を薬剤で固定してそれにHBc抗体をまぶしたものを用意します。これにHBc抗原(コア粒子)を加えますと、それを架け橋としてヒツジ赤血球が凝集し、肉眼でもはっきり判定できます。ところが、HBc抗原をあらかじめHBc抗体と反応させておくと両者が結合してしまうため後に加えたヒツジ赤血球の凝集が阻止されます。献血者の血清を2倍ずつ希釈しておいて、どの希釈(2N)まで凝集が阻止されるかを調べれば、HBc抗体の力価を測定できます。
HBc抗体の力価測定は日本のお家芸で世界中でこれによる献血スクリーニングを施行している国は他にありません。開発当時から、簡単な受身血球凝集阻止反応でHBc抗体が測定されています(図8)。ヒツジ赤血球を薬剤で固定してそれにHBc抗体をまぶしたものを用意します。これにHBc抗原(コア粒子)を加えますと、それを架け橋としてヒツジ赤血球が凝集し、肉眼でもはっきり判定できます。ところが、HBc抗原をあらかじめHBc抗体と反応させておくと両者が結合してしまうため後に加えたヒツジ赤血球の凝集が阻止されます。献血者の血清を2倍ずつ希釈しておいて、どの希釈(2N)まで凝集が阻止されるかを調べれば、HBc抗体の力価を測定できます。
NATで測定できるHBVとHBc抗体の力価との間には一定の関係があります。HBc抗体価が26以上あった献血175単位中、12単位(6.9%)がNATでHBV陽性でしたが、25以下であった119単位の献血では全例が陰性でした。これを根拠として、1989年以来HBc抗体のみ単独陽性の血液では抗体価が26以上あれば棄却し、25以下であればHBV感染性はないと判断し活用する方策がとられHBc抗体陽性血液の有効利用に貢献しました。以来、更なる血液安全性を目指して、HBc抗体価の棄却限界は25以上に改変されました。なお、HBs抗原に対する抗体(HBs抗体)も、同時に受身血球凝集法で測定し、23以上で陽性であればたとえHBc抗体価が25以上ある血液でも、これによってウイルスが中和されてHBV感染性がないので利用されています。
現在行われている各種HBVスクリーニングの守備範囲
献血による輸血後HBV感染を予防するために、現在3種類のスクリーニングが行われています。1972年以来のHBs抗原検査に1989年以後はHBc抗体検査が加わり、そして1999年以来はNAT検査が施行されています。しかし、頻度はきわめて少ないのですが(数十万回に1回)それで完全に輸血後HBV感染を予防することはできないのです。それには二つの理由があります。ひとつは既にご説明しましたように、HBVの増殖速度がHCVとHIVに比べて遙かに遅いことです。もう一つは、HBV感染から離脱して長年経った献血者の中にも僅かですがHBVが血液中に潜んでいる場合があるからです。
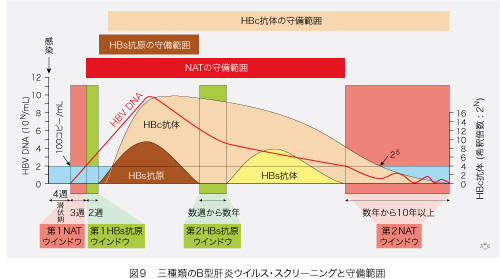 HBs抗原、HBc抗体(抗体価が25以上でHBs抗体陰性)とNATのそれぞれで献血のHBV感染を診断できる期間と診断もれになるウインドウ期間を比較してみましょう(図9)。HBs抗原には感染初期と、それが消失してHBs抗体が血中に出現するまでの期間として、ウインドウが二つあります。NATは、第1HBs抗原ウインドウをカバーします。しかし、HBVが血液中に出現してから濃度が検出限界の100個/mLに達するまで、20日ほどの第1NATウインドウが存在します。
HBs抗原、HBc抗体(抗体価が25以上でHBs抗体陰性)とNATのそれぞれで献血のHBV感染を診断できる期間と診断もれになるウインドウ期間を比較してみましょう(図9)。HBs抗原には感染初期と、それが消失してHBs抗体が血中に出現するまでの期間として、ウインドウが二つあります。NATは、第1HBs抗原ウインドウをカバーします。しかし、HBVが血液中に出現してから濃度が検出限界の100個/mLに達するまで、20日ほどの第1NATウインドウが存在します。
HBc抗体スクリーニングには大きな特典があります。第2HBs抗原ウインドウをカバーできることに加え、感染離脱後にNATが陰性となる第2NATウインドウの一部でもHBc抗体価が25以上ある期間は、血液のHBV感染性診断に役立つのです。しかし、HBc抗体価が24以下であっても、血液中に少量のHBVが出没することがあり、この状態にある献血者からの輸血後HBV感染を予防することはできません。
全体を見て、(1)NATスクリーニングでもHBc抗体スクリーニングによっても、単独では輸血後HBV感染を完全に予防できない時期があり、(2)両方が助け合いお互いのウインドウを上手にカバーしていることがよく分かります。そして(3)HBs抗原スクリーニングだけでHBV感染を検出できる期間はありません。HBs抗原に変異があってHBs抗原測定では感染を検出できないHBV変異体(エスケープ・ミュータント)が存在することを考えると、将来HBs抗原スクリーニングが廃止される可能性すらあります。
NATスクリーニングで輸血後HBV感染が予防できる限界
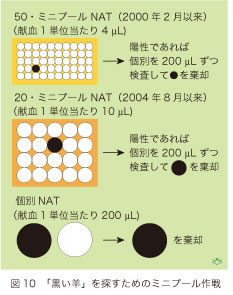 献血のNATスクリーニングは効率を高めるために、あらかじめ複数の血液単位をプールして行われています。NATの処理能力に限界があったので、1999年10月の発足当時は500単位をプールして行われていましたが、2000年2月以来はHBV検出感度を上げるために、50単位をプールして(ミニプールと云います)調べられていました(図10)。あるミニプールがNATでHBV陽性であれば構成員である献血50単位のそれぞれを個別に検査し、NAT陽性の単位を発見して、それだけを棄却すればよいのです。NAT検査の検体量は200マイクロ・リットル(1ミリリットルの千分の一で「mL」と略称します)ですから、各単位の検体量はその50分の1に相当する4 mLとなります。2004年8月以降は、HBVの測定感度を上げるためにプールする単位数を減らして20・ミニプールについてNATが行われています。感度を更に上げるために、献血1単位当たり検体量を200 mLまで増量することができ、個別NATと云われています。
献血のNATスクリーニングは効率を高めるために、あらかじめ複数の血液単位をプールして行われています。NATの処理能力に限界があったので、1999年10月の発足当時は500単位をプールして行われていましたが、2000年2月以来はHBV検出感度を上げるために、50単位をプールして(ミニプールと云います)調べられていました(図10)。あるミニプールがNATでHBV陽性であれば構成員である献血50単位のそれぞれを個別に検査し、NAT陽性の単位を発見して、それだけを棄却すればよいのです。NAT検査の検体量は200マイクロ・リットル(1ミリリットルの千分の一で「mL」と略称します)ですから、各単位の検体量はその50分の1に相当する4 mLとなります。2004年8月以降は、HBVの測定感度を上げるためにプールする単位数を減らして20・ミニプールについてNATが行われています。感度を更に上げるために、献血1単位当たり検体量を200 mLまで増量することができ、個別NATと云われています。
50・ミニプールNATの検体量と比べて、20・ミニプールと個別NATの検体量は、それぞれ2.5倍と50倍に相当しています。ミニプールか個別NATを使った場合に図5で算定された約20日間のNATウインドウを、それぞれ何日間せばめことができるかを考えてみましょう。HBVの倍増時間を2.6日としますと、ウイルス量が2.5倍になるためには約3日、50倍になるためには約14日が必要です。従って、20・ミニプールのウインドウは23(20 + 3)日で、50・ミニプールのウインドウは34(20 + 14)日である、と計算できます。個別NATを採用すればこれを20日にまで短縮するのですが、それでも感染初期にある献血者のNATスクリーニングには限界があることが分かります。
献血1単位を血液200 mLとしますと(400 mL献血も行われています)血清量は約半分として100 mLとなります。個別NATを行ったとしても、全量の500分の1を検査できるだけで、残された99.8%の血清中にHBVの最小感染単位である約10個のウイルスが存在しない、と保証できないのです。もちろん、検体量を更に増加すればNATウインドウをもっと短縮することができますが、これには限界があります。輸血によるHBV感染の危険を完全に除外するためには、100 mL(または200 mL)の血清全量を検査する必要がありますが、そうすると患者さんに輸血する血液がなくなってしまいますので、現実的ではありません。
HBVコア抗体が単独陽性である献血の活用
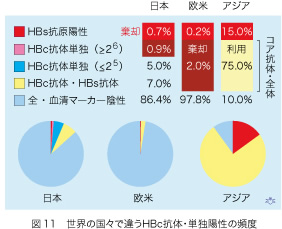 世界中で献血者にHBc抗体のスクリーニングを行い、しかも抗体価を測定してその力価によって活用と棄却を決定している国は日本だけです。他の国々と比べて、日本にはそうせざるを得ない事情があります(図11)。欧米ではHBc抗体陽性の献血者は2%しかいません。この中にはNATスクリーニングでは検出できない、HBV感染性がある感染後期の献血者が含まれています。全体の2%ですので血液棄却が可能な経済限界である3%以下の範囲です。一方、過去にHBV感染が蔓延したアジア諸国にはHBc抗体陽性の献血者が75%もいますから、これを棄却するとHBs抗原陽性の15%とあわせて90%の献血・血液が使い物にならないことになります。これでは血液行政が成り立ちません。たとえHBc抗体が陽性でHBs抗原陰性の輸血を受けても、感受性がある患者さんは10%しかいませんので影響は大きくない筈ですが。
世界中で献血者にHBc抗体のスクリーニングを行い、しかも抗体価を測定してその力価によって活用と棄却を決定している国は日本だけです。他の国々と比べて、日本にはそうせざるを得ない事情があります(図11)。欧米ではHBc抗体陽性の献血者は2%しかいません。この中にはNATスクリーニングでは検出できない、HBV感染性がある感染後期の献血者が含まれています。全体の2%ですので血液棄却が可能な経済限界である3%以下の範囲です。一方、過去にHBV感染が蔓延したアジア諸国にはHBc抗体陽性の献血者が75%もいますから、これを棄却するとHBs抗原陽性の15%とあわせて90%の献血・血液が使い物にならないことになります。これでは血液行政が成り立ちません。たとえHBc抗体が陽性でHBs抗原陰性の輸血を受けても、感受性がある患者さんは10%しかいませんので影響は大きくない筈ですが。
日本の状況は、両者のいずれとも違っています。HBc抗体単独陽性献血の棄却限界が26以上であった頃のデータですが、0.9%がこれに該当しています。抗体価が25以下の献血は5%もあり、血液の供給と需要のバランスからこれを捨てることはできないのです。この方針でHBc抗体が単独陽性である血液の約85%を救済できます。しかも、同時にHBs抗体を測定して抗体価が23以上あれば、たとえHBc抗体が陽性であっても献血された血液を活用しています(7%が、これに該当します)。
こんなにきめの細かい、血液活用の手段を実施している国は世界中で日本以外にはないのです。
スクリーニングをかいくぐったHBV陽性献血による感染例
日本赤十字社は、世界に先駆けて献血・血液の一部を全て保存し、輸血後にHBV感染が発症した症例では使用された全ての単位を個別NATで調べる「遡及調査」を施行しています。新規感染した頻回献血者が見つかった場合には、NATをくぐり抜けたHBV陽性血液の輸血を受けた患者の追跡調査も行われています。輸血以外にもHBV感染の経路があるので、単にHBV陽性の単位があっただけでは証拠が不十分です。HBVの配列を調べて、患者さんと献血・血液の間で一致した場合にのみ、因果関係が実証されます。指紋照合やDNA鑑定のようなものです。
遡及調査によって、意外な事実が判明しました。現行のスクリーニングでは検出できない感染初期のNATウインドウにある血液でも、感染後期のNAT陰性でHBc抗体単独陽性(抗体価24以下)の血液についても(図9をご覧下さい)、遡及調査の個別NATでHBVが陽性であることが判明した血液の輸血を受けた患者の中に、HBV感染は意外に少なかったのです。しかも両者のあいだで感染率に大きな違いがありました。NATスクリーニング陰性で、感染初期にある献血者の血液を輸血された患者さんでは31例中10例(32%)がHBVに感染しましたが、感染後期のHBc抗体単独陽性(抗体価24以下でNATスクリーニング陰性)血液の輸血では僅かに40例中1例(2.5%)しか感染しなかったのです。両者の感染力に約10倍の開きがみられます。チンパンジーの感染実験でも両者の間に10倍から100倍の違いが報告されています。感染後期のHBc抗体単独陽性血液には、検出限界以下の微量HBs抗体が含まれていて、これがHBVと結合して感染力を低下させている可能性があります。
現在のスクリーニングでは漏れてしまうがHBV感染性のある献血を減少させるためには、どうしたらよいでしょうか? 感染初期にある献血者は、過去2ヶ月以内にHBV感染にかかりやすい危険行為(たとえば不特定者との性交渉)を経験した可能性があります。献血時の問診票で、それがあれば正直に申告することが求められていますが、更にこれを徹底する必要があります。献血者の30%が、血液伝搬性ウイルス(HBV、HCVとHIVなど)に感染してから感染を検出できるまでにウインドウ期があることを知りませんから、この事実を周知させる必要があります。良心に従って、HIVの検査を目的とした献血は厳に慎むべきです。HBc抗体低力価単独陽性(24以下でNATスクリーニング陰性)の献血中で、HBVを含む献血を見分けるのはより難しいのですが、日本ではHBVの新規感染がごく少ないので、それも年月と共にやがて減少することが予想されます。
血液安全性に向けた、たゆまぬ努力の結果、輸血後の肝炎ウイルス感染発症率は限りなくゼロに近づきました。しかし、まだ防ぐことができない輸血後肝炎が存在します。現在もさらに血液安全性を高めるために多大な努力が傾注されています。それにも限界がありますので、献血者の良心と倫理観に強く訴えて側面からも血液安全性を向上させる必要があります。
![]()