
![]()
肝臓に発生する癌には、原発性肝癌と転移性肝癌があります。原発性肝癌には肝細胞癌と胆管癌があります。日本では、持続性肝炎ウイルス感染の終末病態である肝硬変を素地として発症する肝細胞癌が肝癌のほとんどを占めています。肝細胞癌は死に至る恐ろしい病気ですが、発症の危険が高い集団を定期的に検査することによって早期発見が可能ですし、適切な治療を行うことにより、生命予後を改善することが可能です。今回は、肝細胞癌の疫学的背景と原因をふまえたスクリーニングの必要性と問題点、ならびに具体的な方法についてお話ししたいと思います。
全世界の各臓器癌と死亡数
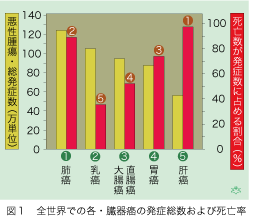
 世界保健機関(World Health Organization [WHO])が集計した西暦2000年の肝癌による死亡数は約55万人で、皮膚癌を除く全ての癌による死亡のほぼ9%に相当します。しかし、実数は遙かに多く、肝細胞癌による死亡は年間100万人を超えると推測されています。皮膚癌を除いた2000年の全世界での悪性腫瘍の発生数は肺癌が首位で、以下乳癌、大腸・直腸癌、胃癌の順となり、肝癌は5位となります(図1)。しかし死亡率を比べると順序が逆転します。発症後1年以内の死亡率は上位5腫瘍の中で肝癌が1位となり、97%にも及びますので肝癌がいかに生命予後の悪い疾患であるかが、よくわかります。ですから、症状が出る以前に早期発見して適切な治療を行う必要があります。
世界保健機関(World Health Organization [WHO])が集計した西暦2000年の肝癌による死亡数は約55万人で、皮膚癌を除く全ての癌による死亡のほぼ9%に相当します。しかし、実数は遙かに多く、肝細胞癌による死亡は年間100万人を超えると推測されています。皮膚癌を除いた2000年の全世界での悪性腫瘍の発生数は肺癌が首位で、以下乳癌、大腸・直腸癌、胃癌の順となり、肝癌は5位となります(図1)。しかし死亡率を比べると順序が逆転します。発症後1年以内の死亡率は上位5腫瘍の中で肝癌が1位となり、97%にも及びますので肝癌がいかに生命予後の悪い疾患であるかが、よくわかります。ですから、症状が出る以前に早期発見して適切な治療を行う必要があります。
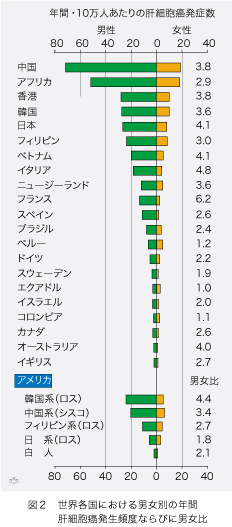
肝細胞癌の大きな特徴の一つは、人口10万人あたりの年間発生頻度が国によって極端に違うことです。アジアとアフリカ諸国が上位7ヶ国までを独占しています(図2)。これに比べてカナダ、オーストラリアとイギリスで低く、上位国のわずか数十分の一しか肝細胞癌が発生しません。
アメリカの大都会には様々な人種の国民が居住していますがそれぞれの肝細胞癌発症率は、祖国の頻度を反映しています。それは更に、祖国のB型肝炎ウイルス(HBV)持続感染の頻度と比例しています。肝細胞癌のもう一つの特徴は男性で女性より発症頻度がずっと高いことです。おしなべて男性では女性より肝細胞癌が3倍から4倍も多く発症します。
日本における肝細胞癌発症の推移と原因
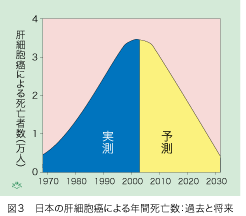 日本では1970年代から肝細胞癌による死亡者数が急速に増加し続けました(図3)。その間HBVによる肝細胞癌はほぼ一定でしたが、C型肝炎ウイルス(HCV)が原因である肝細胞癌は、ほとんど直線的に増加を続けました。これには、いくつかの原因があります。終戦直後の混乱期(1940年代後半)に違法薬物の静脈注射によってHCV感染が危険集団の間で広まり、彼らが繰り返し売血しました。その血液の輸血を受けた患者さんが感染し、更に一般国民にも拡散しました。ディスポーザブル製品の販売以前には消毒が十分でない注射器と注射針の再使用を伴う医療行為によっても、HCV感染が広まり続けました。HCVに感染した人々が数十年の潜伏期の後に、次々と肝細胞癌を発症したのです。
日本では1970年代から肝細胞癌による死亡者数が急速に増加し続けました(図3)。その間HBVによる肝細胞癌はほぼ一定でしたが、C型肝炎ウイルス(HCV)が原因である肝細胞癌は、ほとんど直線的に増加を続けました。これには、いくつかの原因があります。終戦直後の混乱期(1940年代後半)に違法薬物の静脈注射によってHCV感染が危険集団の間で広まり、彼らが繰り返し売血しました。その血液の輸血を受けた患者さんが感染し、更に一般国民にも拡散しました。ディスポーザブル製品の販売以前には消毒が十分でない注射器と注射針の再使用を伴う医療行為によっても、HCV感染が広まり続けました。HCVに感染した人々が数十年の潜伏期の後に、次々と肝細胞癌を発症したのです。
しかしHCV感染率の年齢分布から、HCV感染による日本人の肝細胞癌発症数がやがて頭打ちとなり、のち次第に減少することが予測されていました。どうやら、その時期が既に到来した模様です。肝細胞癌死亡者数は2002年に34,637人で過去最高となりましたが、2003年には34,089人に止まり初めて減少傾向がみられたのです。にも拘わらず将来の数十年間に過去の総数にも匹敵する肝細胞癌が発症することが予想されています。
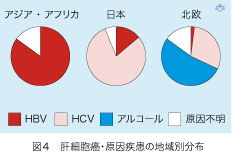 肝細胞癌の原因は世界の国々で大きく違っています(図4)。アジアとアフリカでは肝細胞癌の80%以上でHBVが原因となっています。一方、北欧諸国ではHBVによる肝細胞癌がとても少なく殆どがアジアからの移民に発症します。最近HCVによる肝細胞癌は増加傾向にあり、アルコール性肝硬変患者にも発症します。
肝細胞癌の原因は世界の国々で大きく違っています(図4)。アジアとアフリカでは肝細胞癌の80%以上でHBVが原因となっています。一方、北欧諸国ではHBVによる肝細胞癌がとても少なく殆どがアジアからの移民に発症します。最近HCVによる肝細胞癌は増加傾向にあり、アルコール性肝硬変患者にも発症します。
日本には世界にみられない特徴があります。肝細胞癌の原因として80%がHCV感染、14%がHBV感染で、残りの6%が原因不明です。アルコールが原因となることは希ですが、原因不明の肝硬変と糖尿病および脂肪肝などが肝細胞癌のリスクを増加させると考えられています。肝細胞癌のリスクは、HBV感染で12.6倍、HCV感染で15.3倍、飲酒(1日80グラム以上)で4.5倍、糖尿病で4.3倍、そしてカビ毒の一種であるアフラトキシンの摂食により3.5倍も増加します。複数の危険因子があれば、相加的にリスクが増加します。
肝細胞癌スクリーニングの妥当性
日本人では肝細胞癌の90%以上が持続性HCVまたはHBV感染者に発症します。HCV感染者に発症する肝細胞癌では、ほぼ全例に肝硬変がありますがHBV感染者では肝硬変がなくても、それどころか肝病変が全くない場合にも肝細胞癌が発症します。RNAウイルスであるHCVとは違ってHBVはDNAウイルスですから、肝細胞のゲノム(遺伝子)に組み込まれてしまいます。それが原因で一個の肝細胞が癌化してクローン増殖すると、肝細胞癌が発症します。
 発癌年齢にある40歳以上の国民に検査をして肝細胞癌発症の危険性がある持続性HBV感染者およびHCV感染者を見つけ出し、必要に応じて治療を行うとともに、定期的に肝細胞癌があるかを検査(スクリーニング)すれば肝細胞癌の早期診断ができる筈です。スクリーニングは一時点で対象者に癌があるか・ないかを選別する作業です。危険率が高い集団に定期的検査を行う課程はサーベイランス(監視)として厳密にはスクリーニングと区別されています。慣例上は両者が同等に扱われることが多いので両方を一括してスクリーニングと云うことにします。WHOは癌にスクリーニングを行うべきか、行うべきでないかを判定する8項目の基準を提唱しています(表1)。肝細胞癌は第一から第四項目までを、すべて満たしています。しかし第五から第八までの4項目は、まだ確証が得られていません。スクリーニングの効果判定は、それが対象者の何人で生命を何年延長できるか、によって決まります(第五項目)。「人の生命は地球より重い」と云った宰相がいましたが現実的には「いくらお金がかかっても」とはいかないので、対費用効果の計算が必要になります(第六項目)。米国ではスクリーニングで発見される患者一人の生命を1年間延長するのに必要な総費用は5万ドル(約6百万円)まで、と決められています。
発癌年齢にある40歳以上の国民に検査をして肝細胞癌発症の危険性がある持続性HBV感染者およびHCV感染者を見つけ出し、必要に応じて治療を行うとともに、定期的に肝細胞癌があるかを検査(スクリーニング)すれば肝細胞癌の早期診断ができる筈です。スクリーニングは一時点で対象者に癌があるか・ないかを選別する作業です。危険率が高い集団に定期的検査を行う課程はサーベイランス(監視)として厳密にはスクリーニングと区別されています。慣例上は両者が同等に扱われることが多いので両方を一括してスクリーニングと云うことにします。WHOは癌にスクリーニングを行うべきか、行うべきでないかを判定する8項目の基準を提唱しています(表1)。肝細胞癌は第一から第四項目までを、すべて満たしています。しかし第五から第八までの4項目は、まだ確証が得られていません。スクリーニングの効果判定は、それが対象者の何人で生命を何年延長できるか、によって決まります(第五項目)。「人の生命は地球より重い」と云った宰相がいましたが現実的には「いくらお金がかかっても」とはいかないので、対費用効果の計算が必要になります(第六項目)。米国ではスクリーニングで発見される患者一人の生命を1年間延長するのに必要な総費用は5万ドル(約6百万円)まで、と決められています。
肝細胞癌スクリーニングに伴う3種類の偏り(バイアス)
第五項目にある肝細胞癌スクリーニングの効果判定は、第七項目の治療有効性と第八項目の生命延長期間によって決定されます。これは、少なくとも3種類の偏り(バイアス [bias] ですが適当な訳語がありません)に影響されます。その一つはスクリーニングをすると、臨床症状があって診断される症例よりずっと早期に、肝細胞癌を発見できることです。これは、リードタイム・バイアス(lead time bias)と呼ばれています。極端な例を挙げてみます。たとえ、治療が行われない場合でも、スクリーニングで発見される直径2センチ以下の初期癌が腹痛と腹部膨瘤などの臨床症状を発症するまで進展するのに2年かかるのであれば、発症して初めて肝細胞癌と診断される症例よりその分(2年間)生存期間が長くなります。
二番目にレングス・バイアス(length bias)がありますが、これは肝細胞癌の成長速度に依存しています。進行速度がとても速くて悪性度の高い肝細胞癌ほど、スクリーニングで発見されにくい可能性が高くなります。たとえば、12ヶ月ごとに行うスクリーニングでは、6ヶ月以内に急速に成長して症状がでる肝細胞癌症例の全てを検出することができません。このような症例は、直ちに病院を受診して肝細胞癌を診断されますので、スクリーニングの効果がなかったことになります。
三番目にセレクション・バイアス(selection bias)がありますが、これは選択偏差と邦訳することができます。スクリーニングを受けるためには、何よりも体力、そして時間と費用が必要です。肝硬変患者が肝細胞癌スクリーニングの主たる対象になりますので、病状が進み健康を害しているリスクの高い人は、より軽症で発癌の可能性が低い人より検査を受けにくくなる事情があります。
最後に、スクリーニングには負の側面があることを知っておく必要があります。「肝細胞癌発症の危険がある」ことを知っていたら、気分がよい訳がありません。精神的に動揺して、ときに「うつ状態」となり、日常生活に支障を来すこともあり得ます。以後、肝生検や血管造影などの不快で侵襲を伴い、ごくわずかでも生命を脅かす検査を勧められることにもなりかねません。さらに又「肝細胞癌があるので治療が必要です」と宣告されたとしても誤診の可能性がゼロとはいえません。近代医学がどれほど進歩しても「この世に完璧なものは存在しない」現状を、認めないわけにはいかないようです。
スクリーニングが有効であることを証明した研究
経験と勘に頼らざるを得なかった昔の医学から脱皮を図るために、根拠に基づいた医療(evidence-based medicine [EBM])が求められています。そのため薬効の判定には無作為に患者を2群に分け、それぞれにその薬あるいは外観が全く同じな偽薬(プラセボ)を投与して比較します。また、患者と医者の主観と思いこみを排除する目的で、両者ともに薬あるいは偽薬が投与されたかを知らせないようにすること求められています。判定には統計学的解析が必要ですので、それぞれの群に相当数の患者が必要になります。
欧米の医学者は「C型肝炎患者のスクリーニングは、肝細胞癌の診断には効果があるが、臨床転帰の改善をもたらすかを正確に判定するためには更なる研究が必要である」と結論しています。しかし後でお話しするように腫瘍マーカーの血清診断と画像診断で肝細胞癌の早期発見ができる現在、無作為で有対照の治験は人道学的にも許される訳がありません。まさに「無い物ねだり」で肝細胞癌スクリーニングの延命効果は永遠の謎になってしまうのでしょうか? その上スクリーニングにはバイアスがあり、行われても実効を証明できるとは限りません。
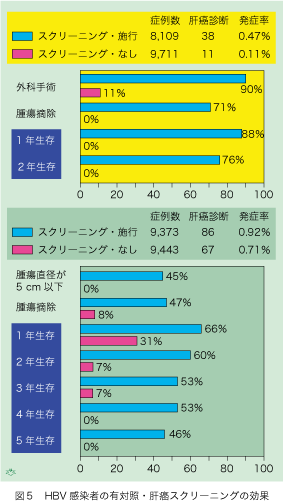 HBV持続感染者を対象とした肝細胞癌スクリーニングの効果判定は過去に中国で2回行われています(図5)。将来は決して行われないであろう貴重な治験で、いずれもそれぞれ1万人近いスクリーニングをうけた群と受けなかった群を比較しています。スクリーニングは血清腫瘍マーカー(alpha fetoprotein [AFP])と超音波による画像診断を6ヶ月毎に施行しています。上段の報告では、スクリーニングによって小さな早期肝細胞癌が発見できるので外科手術で摘除できる機会が90%に達しています。一方、症状が出て発見される肝細胞癌は当然進行しているので外科手術は11%だけで、たとえ腫瘍が発見されても手遅れで摘除できません。スクリーニングを受けた症例は、腫瘍が発見されてから一年後に88%二年後に76%が生存しますが、悲惨なことに発症によって発見される場合には一年後の生存例はありません。二つの集団で年齢と性などが揃えられているのに、スクリーニング集団での肝細胞癌発症率が対照の3倍以上もあることが少し気になります(0.47%対0.11%)。その中には診断して摘除しなくても2年以上は生存したであろう、悪性度の低い症例が含まれていたのかもしれません。
HBV持続感染者を対象とした肝細胞癌スクリーニングの効果判定は過去に中国で2回行われています(図5)。将来は決して行われないであろう貴重な治験で、いずれもそれぞれ1万人近いスクリーニングをうけた群と受けなかった群を比較しています。スクリーニングは血清腫瘍マーカー(alpha fetoprotein [AFP])と超音波による画像診断を6ヶ月毎に施行しています。上段の報告では、スクリーニングによって小さな早期肝細胞癌が発見できるので外科手術で摘除できる機会が90%に達しています。一方、症状が出て発見される肝細胞癌は当然進行しているので外科手術は11%だけで、たとえ腫瘍が発見されても手遅れで摘除できません。スクリーニングを受けた症例は、腫瘍が発見されてから一年後に88%二年後に76%が生存しますが、悲惨なことに発症によって発見される場合には一年後の生存例はありません。二つの集団で年齢と性などが揃えられているのに、スクリーニング集団での肝細胞癌発症率が対照の3倍以上もあることが少し気になります(0.47%対0.11%)。その中には診断して摘除しなくても2年以上は生存したであろう、悪性度の低い症例が含まれていたのかもしれません。
下段の報告も全く同じような結果です。スクリーニングによって直径5センチ以下の、比較的小さな肝細胞癌を発見できる可能性が高いことが示されています。当然、外科的切除のチャンスも多くなります。5年後も半数近い生存例がありますので、スクリーニングの有用性がよくわかります。ただ、HBV持続感染者には肝硬変がないのに肝細胞癌を発症する例が約40%あり、この場合には腫瘍摘出後の予後がよいので、それが長期生存に寄与している可能性があります。ですからこの結果を、殆どが肝硬変に進展しているHCVに持続感染した肝細胞癌患者に、そのまま当てはめることには、無理があります。
肝細胞癌のスクリーニング
肝細胞癌のスクリーニングには、血清学的診断と画像診断の2種類があります。血清学的診断では腫瘍マーカーを測定しますが、主としてAFPとPIVKA-II(protein induced by vitamin K absence or antagonist-II)の2種類があります。AFPは胎生期に肝臓で産生されるタンパクです。生下時には血清中の値が高く、その後減少し4、5歳で成人のレベルになります。しかし肝細胞癌はAFPを産生するので(先祖帰りのようなものです)腫瘍マーカーとなります。PIVKA-IIはビタミンKの欠乏あるいは阻害剤の存在下で誘発される異常タンパクで、活性がない第二血液凝固因子ですがこれも肝細胞癌によって産生されます。進行した肝細胞癌ではAFPとPIVKA-IIが共に陽性となりますが小さな肝細胞癌ではどちらか一方が陽性になることが多いので、両方とも測定する必要があります。
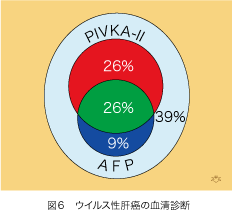 ウイルス性肝細胞癌の症例でAFPとPIVKA-IIを測定した結果は、図6のようになります。PIVKA-II単独陽性は26%でAFP単独陽性の9%よりずっと多く、 肝細胞癌患者の61%はいずれかが陽性となりますが両者が陰性である患者が39%もいます。従って腫瘍マーカーだけでは肝細胞癌の全てを診断することはできませんので、画像診断を併用する必要があります。
ウイルス性肝細胞癌の症例でAFPとPIVKA-IIを測定した結果は、図6のようになります。PIVKA-II単独陽性は26%でAFP単独陽性の9%よりずっと多く、 肝細胞癌患者の61%はいずれかが陽性となりますが両者が陰性である患者が39%もいます。従って腫瘍マーカーだけでは肝細胞癌の全てを診断することはできませんので、画像診断を併用する必要があります。
肝細胞癌の画像診断には、大別して3種類があります。一つは安価で侵襲が少ない超音波(ultrasonography [US])です。二つ目に、恐らく精密診断の最右翼にあるコンピュータ断層撮影(computed tomography [CT])があり第三に磁気共鳴画像(magnetic resonance imaging [MRI])があります。肝細胞癌に出入りする血流を精査するため、超音波では微少炭酸ガス気泡、CTではヨードを含む造影剤が使われます。
現実的には、HBVあるいはHCV持続感染者の超音波と血清腫瘍マーカー(AFPとPIVKA-II)を併用したスクリーニングが慢性肝炎患者では6ヶ月毎に、肝硬変患者では3ヶ月おきを目途として、施行されています。腫瘍の容積が2倍に増加する(直径は1.3倍の増加)までの倍増時間(doubling time)が大多数の肝細胞癌では6ヶ月以下ですので、このような検査頻度が設定されています。
超音波検査で直径が2センチを超える映像が発見されれば、まず肝細胞癌と診断して間違いありません。直径が2センチに満たない、映像の扱い方が、問題となります。直径1センチ以上で2センチ以下の映像には針を使った肝生検が推奨されています。しかし、針生検で採取される肝組織は直径1ミリで長さ2センチ程しかなく標本誤差の影響を受けやすいのです。その上、検査には侵襲が伴いますし僅かとはいえ、生検針に沿って腫瘍細胞が播種される危険性があります。
 そこで、肝生検以外の精密検査であるCTの出番となります。通常の臓器は血液が流入する動脈と流出する静脈を持っていますが、肝臓だけは2系統の流入血管があります(図7)。肝動脈を通じて毎分300ミリリットルの動脈血が流入し酸素と栄養分を供給しています。これに加えて、腸管から摂食した栄養分を運び肝臓に蓄え、タンパクを合成し解毒を行なうために、動脈血流の3倍以上も多い毎分1,000ミリリットルもの血液が門脈を介して流入しています。しかし、肝細胞癌ではこの関係が逆転するのです。悪性化に比例して門脈血流は徐々に減少し、逆に動脈血流が増加して最終的には取って代わることになります。そのため、肝細胞癌は門脈造影中のCTで染まらず、反対に肝動脈造影中CTでは濃染します。
そこで、肝生検以外の精密検査であるCTの出番となります。通常の臓器は血液が流入する動脈と流出する静脈を持っていますが、肝臓だけは2系統の流入血管があります(図7)。肝動脈を通じて毎分300ミリリットルの動脈血が流入し酸素と栄養分を供給しています。これに加えて、腸管から摂食した栄養分を運び肝臓に蓄え、タンパクを合成し解毒を行なうために、動脈血流の3倍以上も多い毎分1,000ミリリットルもの血液が門脈を介して流入しています。しかし、肝細胞癌ではこの関係が逆転するのです。悪性化に比例して門脈血流は徐々に減少し、逆に動脈血流が増加して最終的には取って代わることになります。そのため、肝細胞癌は門脈造影中のCTで染まらず、反対に肝動脈造影中CTでは濃染します。
一般的に静脈内に造影剤を注入し20秒から40秒後の肝動脈相と、50秒から90秒後の門脈相をとらえ10秒間の呼吸制止時間以内に、数ミリ間隔で肝臓断面を描写するCTが、行なわれます。これでも判定困難な症例があり、より侵襲は大きいのですが、血管にカテーテルを挿入して造影剤を注入する肝動脈造影が行なわれています。さらに腸間膜動脈からも造影剤を注入し腸管からの血流を描出する門脈造影も施行されています。門脈血流の減少が肝動脈血流の増加より早く出現するので、肝癌検出感度がより高いと考えられています。
画像診断精度評価の絶対尺度:摘出肝の病理診断
肝細胞癌を疑わせる陰影が画像診断で描出された場合に、果たしてそれが悪性であるか良性であるか、はたまた両者の移行過程にある前癌病変かを診断しなければ治療方針を立てることは困難です。勿論腫瘍部位の針生検という手段がありますが、標本誤差を伴い、病理学的には悪性腫瘍と前癌状態との明確な区別は不可能であることを、専門家も認めています。そうであるならば、経過観察という手が残されています。3ヶ月ないし6ヶ月毎に、侵襲が大きく放射線被曝の多い血管造影CTを繰り返すことは費用の上からも現実的でありませんが超音波検査で陰影面積が増大すれば肝癌、成長しなければ良性の巨大再生結節と考えて、まず間違いありません。したがって、画像診断で肝細胞癌以外の腫瘤を肝細胞癌と診断してしまう偽陽性(false positive)の頻度は少ないのです。逆に、画像診断で検出されない場合に肝細胞癌が存在する可能性、すなわち偽陰性(false negative)が問題となります。肝癌が疑われないので、この場合に針生検による病理診断は不可能です。
不確定事項が多々あるこのような状況で画像診断の感度を鋭敏に評価できる状況があります。肝移植手術で摘出された肝臓を一定間隔の切片とし、肉眼的に腫瘍の有無を検査して、疑わしい場合には顕微鏡的に病理検査を行なうのです。しかし、これにも欠点があります。待機中の患者は、適合した肝臓が入手可能となれば直ちに肝移植を受けなければなりません。ドナーから取り出してから肝臓は急激に傷むので、移植を遅らせてまで手術直前に画像診断はできないのです。また摘出された肝臓を切片とする厚さによっても、肝癌検出の感度が違ってきます。
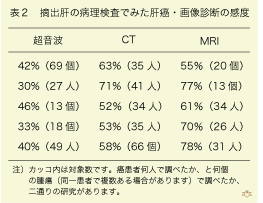 肝癌画像診断正確度の絶対尺度(gold standard)となる摘出肝との対応は、肝細胞癌の根治療法として肝移植が一般化している欧米で行われています。代表的な研究のいくつかを、ご紹介します(表2)。画像診断から、摘出肝病理診断までの経過時間は短くて30日、時に1年を超え、平均して3ヶ月くらいになりますが、これは肝癌危険集団での画像スクリーニングの間隔とほぼ一致しています。摘出肝を刻む間隔も、フォルマリン固定後の3ミリから摘出直後の10ミリまでの幅があります。判定基準として肝癌患者を何人診断できたか、あるいは病理診断された腫瘍の何個を発見できたか、の違いもあります。また、過去10年間に画像診断技術が著しく進化したために報告された肝癌診断感度を、一概に評価することはできませんが、少なくとも二つの結果が見て取れます。
肝癌画像診断正確度の絶対尺度(gold standard)となる摘出肝との対応は、肝細胞癌の根治療法として肝移植が一般化している欧米で行われています。代表的な研究のいくつかを、ご紹介します(表2)。画像診断から、摘出肝病理診断までの経過時間は短くて30日、時に1年を超え、平均して3ヶ月くらいになりますが、これは肝癌危険集団での画像スクリーニングの間隔とほぼ一致しています。摘出肝を刻む間隔も、フォルマリン固定後の3ミリから摘出直後の10ミリまでの幅があります。判定基準として肝癌患者を何人診断できたか、あるいは病理診断された腫瘍の何個を発見できたか、の違いもあります。また、過去10年間に画像診断技術が著しく進化したために報告された肝癌診断感度を、一概に評価することはできませんが、少なくとも二つの結果が見て取れます。
すなわち、(1)画像診断では摘出肝に存在する肝癌の8割以下しか検出できないこと、と(2)CTとMRIの感度は、殆ど同等で、しかも超音波より優れている点です。
画像診断感度は腫瘍の直径にほぼ比例し、1センチ以下の肝癌は見落としが多いようです。
現実的な肝細胞癌スクリーニングの方針
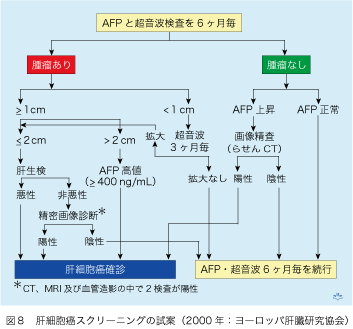 全ての現状をふまえ肝炎ウイルス持続感染患者に対する肝細胞癌スクリーニングの計画を立てなければなりません。まだ統一されたスケジュールはありませんが、2000年にバルセロナでヨーロッパ肝臓研究協会(the European Association for the Study of the Liver [EASL])が起案した肝細胞癌スクリーニング方式は良識的かつ一般的で、全世界のスタンダードとなる可能性があります(図8)。
全ての現状をふまえ肝炎ウイルス持続感染患者に対する肝細胞癌スクリーニングの計画を立てなければなりません。まだ統一されたスケジュールはありませんが、2000年にバルセロナでヨーロッパ肝臓研究協会(the European Association for the Study of the Liver [EASL])が起案した肝細胞癌スクリーニング方式は良識的かつ一般的で、全世界のスタンダードとなる可能性があります(図8)。
この試案では、HBV感染者の全員と、HCV感染やアルコール性など原因の如何を問わず総ての肝硬変患者を対象として、AFPと超音波検査を6ヶ月毎に行なうことが推奨されています。AFP値は、血清1ミリリットル中20ナノグラム(1グラムの100万分の1)以上を陽性と判定します。AFPが、肝細胞癌を診断する感度(癌患者でAFPが陽性になる率)と特異性(AFPが陰性の患者に肝細胞癌が存在しない率)は、いずれも約60%です。超音波検査のそれぞれ70%と90%よりは低いのですが、AFP陽性だけで診断される肝細胞癌症例もあるので、超音波検査陰性の患者で補助診断として役に立ちます。肝生検は腫瘍の直径が1センチ以上で2センチ以下の場合にのみ行ないます。肝生検で肝細胞癌が診断できない例には3種類の映像診断(CT、MRIと血管造影)を行ない、そのうち二つが陽性であれば肝細胞癌を確診できます。スクリーニングの間隔は、あらゆる肝細胞癌の倍増時間を考慮に入れ6ヶ月と暫定されています。日本では、さらにきめ細かく、腫瘍マーカー検査はAFPとPIVKA-IIが隔月で健保適用され、対象も慢性肝炎患者にまで拡大されています。更に肝硬変患者では、3ヶ月毎に画像スクリーニングが行なわれています。
肝細胞癌のスクリーニングによる生命延長効果を、根拠に基づいた医療(EBM)にのっとって無作為・有対照治験で証明し全世界の肝臓病専門家に納得させることは、倫理的な問題がありますし、事実上不可能です。統計学的な有意差が無ければスクリーニングの生命延長効果を認めないのであれば,その実効性は永遠に証明できないでしょう。東西の肝臓病専門家が一堂に会して、素直に現状をとらえ、良識ある結論を導いたのち早急に世界共通のスクリーニング方式が確立されることが、一刻も早く望まれます。
![]()