
![]()
今回は、すこし込み入ったお話です。でも、B型肝炎ウイルス(HBV)感染の深奥に迫る問題なのです。実は未だ歴史が浅く専門家の間でも、また国によっても、統一した見解に至ってはいません。実態は掴めていませんし、全貌が明らかになるとも思えません。それだからこそ、正確な理解と正しい対応に向けて、たゆまぬ努力を怠ってはならない重大なテーマです。
HBV感染の診断
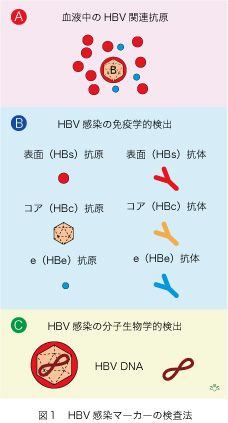 HBVに感染したヒトの血液中に何があるかを、まず見てみましょう(図1A)。勿論ウイルス本体がありますが、それ以外に、ウイルスを含まない「ころも(エンベロープ)」タンパクで作られた小型表面抗原(hepatitis B surface antigen [HBsAg])粒子が、数としてはHBVの千倍くらいあります。他にウイルスが盛んに増殖しているときに産生されるe抗原(hepatitis B e antigen [HBeAg])がありますが、分子量が小さいので電子顕微鏡でも見ることが出来ません。HBVの内部には正二十面体の核(コア)がありウイルスの遺伝子(本体)がその中に含まれています。コアにも特有の抗原性(HBc抗原)があります。
HBVに感染したヒトの血液中に何があるかを、まず見てみましょう(図1A)。勿論ウイルス本体がありますが、それ以外に、ウイルスを含まない「ころも(エンベロープ)」タンパクで作られた小型表面抗原(hepatitis B surface antigen [HBsAg])粒子が、数としてはHBVの千倍くらいあります。他にウイルスが盛んに増殖しているときに産生されるe抗原(hepatitis B e antigen [HBeAg])がありますが、分子量が小さいので電子顕微鏡でも見ることが出来ません。HBVの内部には正二十面体の核(コア)がありウイルスの遺伝子(本体)がその中に含まれています。コアにも特有の抗原性(HBc抗原)があります。
HBV感染を診断するために、二通りの方法があります。一つは血清指標(マーカー)を測定するやり方で、三種類の抗原抗体系があります(図1B)。表面抗原が最も重要で、これが陽性であればHBVが存在すると考えて間違いありません。逆に表面抗原が陰性となれば、HBV感染が治癒した証拠になります。コアは表面抗原に包まれていますので、それを特別な方法で露出しない限り血液中で検出することは出来ません。一方、コア抗体はHBV増殖がある限り盛んに産生されますから、抗体の力価を測定することによって感染性の強さを知ることが出来ます。これ以外にe抗原とe抗体系があります。HBs抗原陽性の血液にe抗原が存在すれば感染性が高く、また肝臓病があれば重症度が高いので、臨床的にとても役に立つHBV感染の血清マーカーとなります。逆にe抗体があれば、血液の感染性が低く肝臓病も沈静化した、と一般的に考えることが出来ます。
最後に、分子生物学的診断法があります(図1C)。ウイルスがあるか・ないかの検査ですので、表面抗原測定による間接的なHBVの感染診断より1万倍以上も鋭敏です。血液から核酸を抽出して、HBVの遺伝子(HBV DNA)を取り出し、それをポリメラーゼ連鎖反応(polymerase chain reaction [PCR])で増幅した後に測定します。最新の方法を使いますと、血清1ミリリットル(mL)中にHBVが10個もあれば検出できます。しかし、分子生物学的なHBV診断法にも限界があります。検査に使う血清は0.1 mLですが、体中には約3,000 mLもの血清が含まれています。従って、検査できる血清はその僅か3万分の1だけです。たとえ0.1 mLにHBVが10個以下であることがわかっても、体内の血清全体にHBVが存在しないとは、とても言い切れないのです。
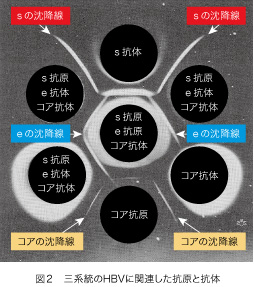 抗原抗体反応は、約80年以前から簡単な二重免疫拡散法(創造者の名前にちなんでオクタロニー法と云われています)で測定されていました。寒天に小さな丸い穴をあけて、それぞれに抗原と抗体を注入します。一晩おいて下から光を当てますと、対応した抗原と抗体の間に白い沈降線が現れます。この方法には抗原と抗体の測定に加えて、特異性までをも知ることが出来る強みがあります。抗原抗体系が違う場合には、それぞれが作る二本の沈降線がお互いを乗り越えて交差するのです。図2で、表面(s)抗原と表面(s)抗体、e抗原とe抗体、そしてコア抗原とコア抗体が作る3種類の沈降線が、お互いを乗り越えて交差し、したがってそれぞれの免疫学的特異性が違っていることをご確認ください。この方法で表面抗原と表面抗体が発見されたのは1964年で、e抗原e抗体系は1972年、そしてコア抗原コア抗体系は1974年に見つかっています。ですから、約30年以上も前に三系統のHBVに関連した抗原抗体系の全てが出揃って、それぞれが現在まで継承されているのです。
抗原抗体反応は、約80年以前から簡単な二重免疫拡散法(創造者の名前にちなんでオクタロニー法と云われています)で測定されていました。寒天に小さな丸い穴をあけて、それぞれに抗原と抗体を注入します。一晩おいて下から光を当てますと、対応した抗原と抗体の間に白い沈降線が現れます。この方法には抗原と抗体の測定に加えて、特異性までをも知ることが出来る強みがあります。抗原抗体系が違う場合には、それぞれが作る二本の沈降線がお互いを乗り越えて交差するのです。図2で、表面(s)抗原と表面(s)抗体、e抗原とe抗体、そしてコア抗原とコア抗体が作る3種類の沈降線が、お互いを乗り越えて交差し、したがってそれぞれの免疫学的特異性が違っていることをご確認ください。この方法で表面抗原と表面抗体が発見されたのは1964年で、e抗原e抗体系は1972年、そしてコア抗原コア抗体系は1974年に見つかっています。ですから、約30年以上も前に三系統のHBVに関連した抗原抗体系の全てが出揃って、それぞれが現在まで継承されているのです。
HBV感染の経過
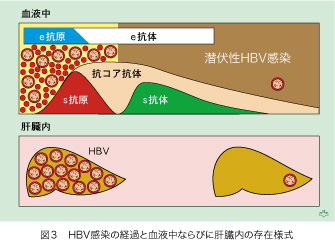 さてHBV感染後に、これらの血清マーカーはどのように推移するのでしょうか? HBVが体内に侵入した後に、二通りの経過があります。幼少時(母児感染と3〜5歳までの水平感染)にHBVが体内に入りますと感染が持続する可能性が高くなりますが、これは免疫系がまだ未熟でHBV関連抗原を自己タンパクと誤認してしまうためです。それ以後に、特に成人となってからのHBV感染は一過性(6ヶ月以内)で治癒します。持続性感染では30〜40年後に慢性肝疾患が発症し、やがて約30%は重症化(肝硬変と肝細胞癌)します。一過性感染すると、急性肝炎となり(70%は無症候感染です)感染は約6ヶ月で治癒しますが、HBV血清マーカーの動向は時間軸を延長すれば持続感染とほぼ同じです(図3)。表面(s)抗原があるか・ないかと、表面(s)抗体の出現が勝負所となります。血液中に表面抗原がある期間中は、ウイルス本体(HBV)が存在する、と考えて間違いありません。逆に表面抗体が出現すれば以後は血清中にHBVの感染性がない証拠となります。抗コア抗体は、最後まで残りますが、過去にHBV感染があった証拠となります。e抗原は表面抗原陽性の初期に出現し、その後はe抗体が出現しますが、やがて消失します。
さてHBV感染後に、これらの血清マーカーはどのように推移するのでしょうか? HBVが体内に侵入した後に、二通りの経過があります。幼少時(母児感染と3〜5歳までの水平感染)にHBVが体内に入りますと感染が持続する可能性が高くなりますが、これは免疫系がまだ未熟でHBV関連抗原を自己タンパクと誤認してしまうためです。それ以後に、特に成人となってからのHBV感染は一過性(6ヶ月以内)で治癒します。持続性感染では30〜40年後に慢性肝疾患が発症し、やがて約30%は重症化(肝硬変と肝細胞癌)します。一過性感染すると、急性肝炎となり(70%は無症候感染です)感染は約6ヶ月で治癒しますが、HBV血清マーカーの動向は時間軸を延長すれば持続感染とほぼ同じです(図3)。表面(s)抗原があるか・ないかと、表面(s)抗体の出現が勝負所となります。血液中に表面抗原がある期間中は、ウイルス本体(HBV)が存在する、と考えて間違いありません。逆に表面抗体が出現すれば以後は血清中にHBVの感染性がない証拠となります。抗コア抗体は、最後まで残りますが、過去にHBV感染があった証拠となります。e抗原は表面抗原陽性の初期に出現し、その後はe抗体が出現しますが、やがて消失します。
HBV感染の診断が、抗原抗体反応だけで行われていた時代には「血清中の表面抗原が消失すれば、HBV感染は治癒する」と考えられていました。1980年代になって、分子生物学的にHBV DNAを測定できるようになると、HBVの持続感染と一過性感染の意外な事実が、浮かび上がってきました。血液中の表面抗原が消失した以後にも、HBV感染が存続することが判明したのです。しかも、HBV DNAの測定法が進化して感度が高くなるにつれて、その範囲が拡大し続けているのです。表面抗原が陽性と陰性の血清間で、HBV量の違いは勿論あります。血清中のHBVは表面抗原が陽性の期間には1012〜106/mLもありますが、表面抗原が陰性となってからは103/mL以下となり、その間に千倍以上の開きがあります。血液中にHBV DNAが検出されれば、肝臓内にHBVが感染している証拠です。表面抗原陽性期には肝細胞1個あたり5〜50個のHBVが感染していますが、表面抗原の消失後はこれが0.01〜0.001個に低下しますので、血液中と同じくらいの違いがあります。肝細胞の数は1兆(1012)個ありますので、たとえ細胞あたり0.001個のHBVがいたとしても、合計すると血液中の表面抗原消失後にも約10億個のウイルスが存続することになります。その一部が血液中に放出されることが、潜伏性HBV感染の問題点となります。
潜伏性HBV感染の診断
 実際には潜伏性HBV感染がないのに誤診される状況がいくつかあります(表1)。かなりの割合で、HBV DNA測定の偽陽性(false positiveで、HBV DNA陰性が誤って陽性と判定されます)があります。測定方法が鋭敏になるにつれ、同時測定する沢山の血清サンプル中のHBV DNA陽性血清から、たまたま他の血清に微量のウイルスが混入して、これを陽性と判定してしまう頻度が高くなります。何十年も血清を冷凍保存しておいて、しかも過去に何回も検査した経歴があれば、HBV混入の機会は増加します。測定法それ自体の信頼性(特異性)も影響します。このためHBV DNAの少なくとも3領域(S遺伝子、C遺伝子とX遺伝子それぞれの一部)をPCR法で増幅し、そのうち少なくとも二つが陽性であれば、潜伏性HBV感染を診断するという厳格な規定がもうけられました。
実際には潜伏性HBV感染がないのに誤診される状況がいくつかあります(表1)。かなりの割合で、HBV DNA測定の偽陽性(false positiveで、HBV DNA陰性が誤って陽性と判定されます)があります。測定方法が鋭敏になるにつれ、同時測定する沢山の血清サンプル中のHBV DNA陽性血清から、たまたま他の血清に微量のウイルスが混入して、これを陽性と判定してしまう頻度が高くなります。何十年も血清を冷凍保存しておいて、しかも過去に何回も検査した経歴があれば、HBV混入の機会は増加します。測定法それ自体の信頼性(特異性)も影響します。このためHBV DNAの少なくとも3領域(S遺伝子、C遺伝子とX遺伝子それぞれの一部)をPCR法で増幅し、そのうち少なくとも二つが陽性であれば、潜伏性HBV感染を診断するという厳格な規定がもうけられました。
しかし過去、これ程厳密には診断しなかった「潜伏性HBV感染」の結果も含めて、討論されているのが現状です。
S遺伝子の突然変異のために表面(HBs)抗原タンパクの抗原基が変化して、検出できなくなることがあります。この場合には変異体であるウイルスが共存していますので、沢山のHBVが存在します。また、血液中に表面抗原が含まれていても、表面抗体と結合して免疫複合体を形成しているため測定できないことがあります。この場合には見かけ上は陰性ですが、実際には表面抗原が含まれています。しかし、これらの原因が潜伏性HBV感染に占める割合は少ないと考えられています。結局「現行の測定法の感度以下でしかない微量の表面抗原が含まれている」状態が主体となっています。従って将来、表面抗原測定法が進歩して今より感度がずっと上昇すれば、潜伏性HBV感染が減少する可能性があります。
潜伏性HBV感染の頻度
 潜伏性HBV感染の手がかりとなる表面抗体かコア抗体あるいは両方を含む血清で調べたHBV DNA陽性の頻度(すなわち潜伏性HBV感染の頻度)は、検査する対象によって大きく違います。国民の感染密度が高い国では潜伏性HBV感染頻度が多く、低い国では少なくなります(表2)。いくつかの代表国をあげますと日本とアフリカで約20%、北米は5%そして北欧では1%以下となりますが、まだ詳しく調べられていない国も多いのです。潜伏性HBV感染の頻度は、肝疾患の有無に影響されます。正常人(献血者)と比べて、慢性肝炎患者に潜伏性HBV感染が多く肝細胞癌患者では更に頻度が高くなります。肝細胞癌患者でC型肝炎ウイルス(HCV)に感染しHCV抗体陽性である症例では陰性症例より潜伏性HBV感染の頻度が高いのですが、これにはあとでお話しする理由があります。
潜伏性HBV感染の手がかりとなる表面抗体かコア抗体あるいは両方を含む血清で調べたHBV DNA陽性の頻度(すなわち潜伏性HBV感染の頻度)は、検査する対象によって大きく違います。国民の感染密度が高い国では潜伏性HBV感染頻度が多く、低い国では少なくなります(表2)。いくつかの代表国をあげますと日本とアフリカで約20%、北米は5%そして北欧では1%以下となりますが、まだ詳しく調べられていない国も多いのです。潜伏性HBV感染の頻度は、肝疾患の有無に影響されます。正常人(献血者)と比べて、慢性肝炎患者に潜伏性HBV感染が多く肝細胞癌患者では更に頻度が高くなります。肝細胞癌患者でC型肝炎ウイルス(HCV)に感染しHCV抗体陽性である症例では陰性症例より潜伏性HBV感染の頻度が高いのですが、これにはあとでお話しする理由があります。
潜伏性HBV感染の頻度は血清マーカーによっても違います。コア抗体単独陽性の血清で頻度が高く、表面抗体陽性の血清では頻度が低いことが知られています。対象集団の全例にHBV DNA検査を施行して、陽性例を血清マーカーと対比した研究では、驚くべきことに、HBV DNA陽性でセロネガテイブ(表面抗体もコア抗体も陰性)の症例が20%もあったそうです。普通はこんなことをしませんが、潜伏性HBV感染の実態を知るためにベストの方法です。現実には血清マーカー陽性例に限ってHBV DNA検査を行っていますので、その結果かなりの潜伏性HBV感染を見逃していることになり奥行の深さを彷彿させます。
潜伏性HBV感染の悪影響
 潜伏性HBV感染が人類の健康に及ぼす影響には三通りあります(表3)。一つはドナーからのHBV感染です。代表は潜伏性HBV感染ドナーから肝移植を受ける患者(レシピエント)に発生するHBV感染です。その頻度は、レシピエントのコア抗体と表面抗体に影響されます。潜伏性HBV感染ドナーから肝移植を受ける患者が抗体陰性(セロネガテイブ)であると、90%以上の頻度で移植した肝臓にB型肝炎が発症します。しかし、レシピエントが表面抗体陽性であると移植肝にB型肝炎は起きにくいことが知られています。このため劇症肝炎など緊急性がある症例は別として、潜伏性HBV感染ドナーから肝移植を受ける患者は、できれば表面抗体陽性(少なくとも、コア抗体陽性)に限るか、あらかじめワクチンを接種して表面抗体陽性となってから肝移植する方策がとられています。潜伏性HBV感染ドナーから肝臓以外の臓器移植を受ける患者では、術後のHBV感染がずっと少なくなります。これは、HBVが肝臓以外では増殖できないためです。
潜伏性HBV感染が人類の健康に及ぼす影響には三通りあります(表3)。一つはドナーからのHBV感染です。代表は潜伏性HBV感染ドナーから肝移植を受ける患者(レシピエント)に発生するHBV感染です。その頻度は、レシピエントのコア抗体と表面抗体に影響されます。潜伏性HBV感染ドナーから肝移植を受ける患者が抗体陰性(セロネガテイブ)であると、90%以上の頻度で移植した肝臓にB型肝炎が発症します。しかし、レシピエントが表面抗体陽性であると移植肝にB型肝炎は起きにくいことが知られています。このため劇症肝炎など緊急性がある症例は別として、潜伏性HBV感染ドナーから肝移植を受ける患者は、できれば表面抗体陽性(少なくとも、コア抗体陽性)に限るか、あらかじめワクチンを接種して表面抗体陽性となってから肝移植する方策がとられています。潜伏性HBV感染ドナーから肝臓以外の臓器移植を受ける患者では、術後のHBV感染がずっと少なくなります。これは、HBVが肝臓以外では増殖できないためです。
潜伏性HBV感染ドナーからの造血幹細胞移植(骨髄移植など)レシピエントにも、HBV感染が発症します。潜伏性HBV感染ではリンパ球などの血液細胞にHBVが取り込まれ、長年生存しています。表面抗体をもたないレシピエントでは、それが肝臓に感染する可能性があります。
輸血は臓器移植より格段に例数が多いので、潜伏性HBV感染ドナーが供血する血液の安全性が問題となります。国民のHBV感染頻度が低い欧米では、ドナーをセロネガテイブに限定することができますが、日本を含めたアジア諸国では血液の棄却率が高くなるので現実的ではありません。潜伏性HBV感染の頻度はコア抗体の力価と比例しますので、日本では一定以上のコア抗体単独陽性血液は使用しないことで、輸血後HBV感染の殆どを予防しています。コア抗体陽性でも表面抗体が含まれている血液にはHBV感染性がないので利用されています。しかし低力価のコア抗体単独陽性ドナーの中にまぎれ込んでいる潜伏性HBV感染者を、完全には除外できないので輸血後HBV感染の可能性がごく僅か残ります。でも、万一それが輸血されてもレシピエントがHBV感染する頻度は低いことが知られています。日赤の遡及調査の結果では、潜伏性HBV感染ドナーが献血した血液を輸血した後のHBV感染は、レシピエント40例中でたった1例(2.5%)だけでした。
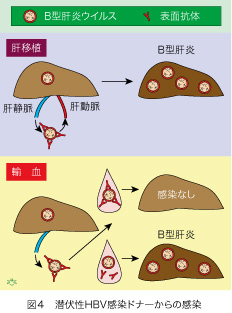 潜伏性HBV感染ドナーからの肝移植と輸血で、レシピエントのHBV感染頻度に格段の差があることには理由があります(図4)。ドナーの肝臓には少数のHBVが含まれていますが、肝臓内で感染が拡大して肝炎を起こすことは希です。これはHBVが表面抗体と結合して中和されるので感染性がないためです。しかし、肝臓自体にはHBVが含まれていますので、表面抗体がないレシピエントに移植すると、薬剤投与によって免疫防御が低下するために、感染が起こります。
潜伏性HBV感染ドナーからの肝移植と輸血で、レシピエントのHBV感染頻度に格段の差があることには理由があります(図4)。ドナーの肝臓には少数のHBVが含まれていますが、肝臓内で感染が拡大して肝炎を起こすことは希です。これはHBVが表面抗体と結合して中和されるので感染性がないためです。しかし、肝臓自体にはHBVが含まれていますので、表面抗体がないレシピエントに移植すると、薬剤投与によって免疫防御が低下するために、感染が起こります。
潜伏性HBV感染ドナーの血液中にあるHBVは中和抗体と結合して免疫複合体を形成していますので、輸血してもレシピエントの肝臓に感染し増殖することは殆どありません。しかし、輸血後に血液が希釈されると中和抗体が解離してHBVが感染性を持つようになる可能性があります。その場合に限って、輸血後HBV感染が起こると考えられます。
第二の悪影響は、潜伏性HBV感染者に起こるB型肝炎の再発です。潜伏性HBV感染は、宿主の免疫反応によって沈静化されています。従って、免疫が低下する状況ではHBVが勢力を取り戻して、感染が再発し表面抗原陽性になります。典型的な例として、免疫抑制療法を受けるリンパ腫の患者があります。抗癌剤と、抗リンパ球抗体使用によって免疫が極度に抑制されるために、患者に潜伏性HBV感染がある場合には、HBV再発の危険性が生じます。
第三に潜伏性HBV感染それ自体が肝疾患を起こすか、助長する可能性が指摘されています。原因が不明の慢性肝疾患(肝炎、肝硬変と肝細胞癌)患者で、潜伏性HBV感染が果たして危害を及ぼしているか否か、が問題となります。原因がわからないので「潜伏性HBV感染のせいにしてしまえ!」の風潮もあるようです。また潜伏性HBV感染者に肝生検を施行して、組織を調べると軽度の炎症と線維化の所見が得られることも、その根拠とされています。しかし、これには問題があります。
肝炎の原因が全部はわかっていないので、潜伏性HBV感染以外にも病原となる因子の存在を否定できません。更に、大きな落とし穴があります。慢性肝疾患・患者が過去にB型肝炎に罹患していた既往があり、数十年の経過中に表面抗原を失って潜伏性HBV感染に移行しているかもしれません(図3の上段をご覧ください)。この場合には、潜伏性HBV感染が肝臓病の「原因」ではなくて、過去に肝炎を起こしたHBV感染の「結果」であることになります。本末転倒ですので両者を区別するため多大な注意と用心が必要です。
別のメカニズムですが、他にアルコールの過剰摂取とかHCV感染あるいは鉄分の沈着と肥満などの肝障害因子がある場合に、潜伏性HBV感染がそれを助長する共因子(cofactor)として働き、肝疾患を悪化させる可能性は除外できません。将来の精力的な研究が必要な分野です。
潜伏性HBV感染とC型肝細胞癌
近年、日本人に肝細胞癌が多発して、年間3万5千人もの死亡例があります。その80%にHCVが感染し、14%がHBV感染(表面抗原陽性)で、残りの6%が原因不明です。日本で肝細胞癌が多い原因として、潜伏性HBV感染の関与が疑われました。理由はC型肝細胞癌患者でコア抗体陽性の頻度が高かったことです。何十編もの論文が発表されましたが、C型肝細胞癌患者のコア抗体陽性は、軒並み70%に及ぶ高い頻度でした。肝臓の組織にも、ほぼ全例でHBV DNAが検出されています。「ウイルスがまだいるぞ!」と「なにか悪さをしているに違いない」の推測から、潜伏性HBV感染がHCVと協力して肝細胞癌の発生を助長している、と結論されました。「だから、日本人には肝細胞癌が多いのだ」とも云われています。
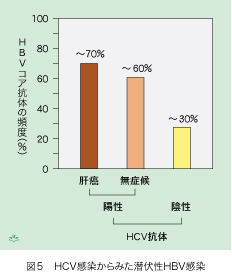 しかし、一概にそうとは言い切れない事情があります。日本人では、HBV感染既往の頻度がもともと高いのです。その上、HBVもHCVも血液を介して感染しますから伝搬経路が共通しています。片方のウイルスに感染する危険があった人々では他方のウイルスにも感染する機会が多かった筈だ、との推測が成り立ちます。HCV感染のあり・なしを基準として、その角度からみると、そうであったらしいことが分かります(図5)。結論は二つあります。一つにはHCV抗体陽性患者は、陰性患者よりコア抗体陽性(一部が潜伏性HBV感染)頻度が高いことです。もう一つはHCV抗体陽性者の中では、肝癌患者と無症候性感染者(キャリア)との間でコア抗体の陽性頻度に殆ど差がないことです。肝細胞癌があってもなくても、HCV抗体陽性の人には60%から70%の高い頻度で過去にHBV感染の既往があった事実は、潜伏性HBV感染が肝細胞癌の発症を助長する可能性が少ないことを示す、疫学的な証拠となります。
しかし、一概にそうとは言い切れない事情があります。日本人では、HBV感染既往の頻度がもともと高いのです。その上、HBVもHCVも血液を介して感染しますから伝搬経路が共通しています。片方のウイルスに感染する危険があった人々では他方のウイルスにも感染する機会が多かった筈だ、との推測が成り立ちます。HCV感染のあり・なしを基準として、その角度からみると、そうであったらしいことが分かります(図5)。結論は二つあります。一つにはHCV抗体陽性患者は、陰性患者よりコア抗体陽性(一部が潜伏性HBV感染)頻度が高いことです。もう一つはHCV抗体陽性者の中では、肝癌患者と無症候性感染者(キャリア)との間でコア抗体の陽性頻度に殆ど差がないことです。肝細胞癌があってもなくても、HCV抗体陽性の人には60%から70%の高い頻度で過去にHBV感染の既往があった事実は、潜伏性HBV感染が肝細胞癌の発症を助長する可能性が少ないことを示す、疫学的な証拠となります。
全世界で約4億人がHBVに持続感染し、総人口の半数に相当する30億人以上の人々で一過性感染の経験があります。その20%に潜伏性HBV感染があったとしても6億人となりますが、実数はこれを超える可能性があります。感度のよい方法で血液中のHBV DNAを測定し肝臓の中を調べれば、潜伏性HBV感染の総数は更に増加するでしょう。裾野が限りなく広がっていく分野で、その影響は計り知ることができません。確かな事象と不確実で誤った認識を厳格に区別して、潜伏性HBV感染に正しく対面し対処することが必要です。将来の幅広い研究とその成果が待たれます。
![]()