
A型肝炎ウイルス感染が健康に及ぼす絶大な影響
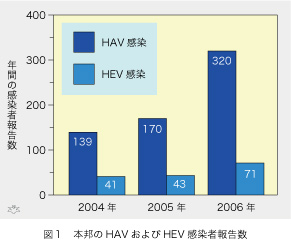 経口感染する肝炎ウイルスには A型肝炎ウイルス(HAV)とE型肝炎ウイルス(HEV)の二種類があります。前回の『続・肝炎ウイルス十話』の第三話「本邦におけるE型肝炎ウイルス感染の影響と今後の対応」では、HEVを取り上げさせて頂きました。今回は引き続きHAVをテーマにしたいと思いますが、実はHAVの方がHEVよりは人類の健康に及ぼす影響がずっと大きいのです(図1)。感染症サーベイランスに公示されている3年間の最新のデータを見ると、HAV感染の合計629例に対してHEV感染の合計は155例ですから、4倍の開きがあります。 報告率が低いので、実数はこの10倍以上はある筈です。近年、特にHAV感染症例数が増加する傾向にある事が注目されます。死亡する例が多く、最も恐ろしい劇症肝炎に限りますと、1998から2003年までにA型が45例で、E型3例の15倍も多いのです。
経口感染する肝炎ウイルスには A型肝炎ウイルス(HAV)とE型肝炎ウイルス(HEV)の二種類があります。前回の『続・肝炎ウイルス十話』の第三話「本邦におけるE型肝炎ウイルス感染の影響と今後の対応」では、HEVを取り上げさせて頂きました。今回は引き続きHAVをテーマにしたいと思いますが、実はHAVの方がHEVよりは人類の健康に及ぼす影響がずっと大きいのです(図1)。感染症サーベイランスに公示されている3年間の最新のデータを見ると、HAV感染の合計629例に対してHEV感染の合計は155例ですから、4倍の開きがあります。 報告率が低いので、実数はこの10倍以上はある筈です。近年、特にHAV感染症例数が増加する傾向にある事が注目されます。死亡する例が多く、最も恐ろしい劇症肝炎に限りますと、1998から2003年までにA型が45例で、E型3例の15倍も多いのです。
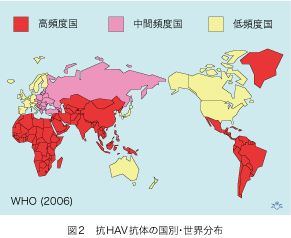 医学研究の成果は、論文として発表されます。ですから、HAVとHEV関連論文数の推移を見れば研究の活動度と動向が分かります。前回(第三話)の図1をご覧ください)。1990年から2008年まで約20年間の経口感染肝炎ウイルス論文数を、米国医学蔵書(NLM [National Library of Medicine])のデータベースで集計し、著者に日本人が含まれる論文数を数えてみました。HAV論文の総数は766編で、そのうち47編(6.1%)が日本発信です。一方、HEV論文の総数は651編で、日本発信は94編(14.4%)もあります。日本発HEV論文の伸びは2003年後が目覚ましく、同年に発足した厚生労働省E型肝炎研究班の活動が、大いに貢献しています。そのお陰もあって、HAV研究の不振が目立ちます。HAVは全世界に広く分布していて、HAV抗体頻度から推定できる感染密度はアジア・アフリカと中南米で特に高いのです(図2)。人類の健康を損なう影響力の大きさは、HAVのほうがHEVよりは格段に大きく、少なくとも10倍以上あることが推測できますから、疾患の重要度と比べてHAVは不当に軽んじられている事になります。この温度差は、いったい何が原因なのでしょうか?
医学研究の成果は、論文として発表されます。ですから、HAVとHEV関連論文数の推移を見れば研究の活動度と動向が分かります。前回(第三話)の図1をご覧ください)。1990年から2008年まで約20年間の経口感染肝炎ウイルス論文数を、米国医学蔵書(NLM [National Library of Medicine])のデータベースで集計し、著者に日本人が含まれる論文数を数えてみました。HAV論文の総数は766編で、そのうち47編(6.1%)が日本発信です。一方、HEV論文の総数は651編で、日本発信は94編(14.4%)もあります。日本発HEV論文の伸びは2003年後が目覚ましく、同年に発足した厚生労働省E型肝炎研究班の活動が、大いに貢献しています。そのお陰もあって、HAV研究の不振が目立ちます。HAVは全世界に広く分布していて、HAV抗体頻度から推定できる感染密度はアジア・アフリカと中南米で特に高いのです(図2)。人類の健康を損なう影響力の大きさは、HAVのほうがHEVよりは格段に大きく、少なくとも10倍以上あることが推測できますから、疾患の重要度と比べてHAVは不当に軽んじられている事になります。この温度差は、いったい何が原因なのでしょうか?
HAV:肝炎ウイルスの優等生
HAV感染の歴史は、少なくとも5世紀にまでさかのぼることができます。17世紀になってヨーロッパで大流行し、1923年に感染性疾患であることが確認されました。感染経路の違いと臨床経過からHAVがB型肝炎ウイルス(HBV)と違うことが判明したのは、第二次世界大戦中(1939〜1945年)に米国兵士に発症した二種類の伝染性肝炎が異なる疾患であったこと、ならびに1950〜1960年代に行われた感染実験の結果に起因しています。1970年代前半にHAV研究は目覚ましい進歩を遂げました。1973年に 米国・国立衛生研究所で、Stephen Feinstoneは感染源を接種され急性肝炎を発症した篤志家の便を調べました。そして4名中2名の糞便抽出液の中に、回復期の血清で凝集する直径27ナノメートル(1ナノメートルは1ミリの百万分の一)のウイルス粒子を、免疫電子顕微鏡で発見したのです。HAVを精製できたので、これを使って患者の血清中にウイルス粒子と結合する免疫グロブリン(抗体)があるか、ないかを調べる事ができるようになりました。感染後まず出現し、やがて消失するIgM型HAV抗体があれば、A型急性肝炎と診断されます。遅れて出現し長期間持続するIgG型HAV抗体は、過去にHAV感染があった証で、患者の肝炎症状とは関係ないことが判明したのです。
大勢の研究者が培養細胞をHAVで感染させ、実験的に増殖させることを試みましたが、なかなか成功しませんでした。1975年になって米国のMerck研究所で、Philip Provostがマーモセットの培養肝細胞をHAVに感染させることに成功しました。この方法でHAVを増殖させ、多量のウイルス粒子を得ることができるようになりました。これを使って、各種HAV抗体を測定できるようになりました。更にHAVをフォルマリンで不活化して感染力を消失させ、それをマーモセットに注射すると、HAV抗体が産生されて感染を防御できることを証明し、ワクチン製造への道を確立したのです。
Feinstoneのウイルス発見とProvostの不活化ワクチン開発の時点で、HAV感染の診断と予防が達成されました。HAV感染が慢性化しないことも手伝って研究費が枯渇したため、1970年代の後半には医学者の関心を失ってしまったのです。HAVは「肝炎ウイルスの優等生」と云えます。研究のテンポが速かっただけに、終結も即座に訪れました。「佳人薄命」とはよく云ったものです。
先進国におけるHAVの逆襲
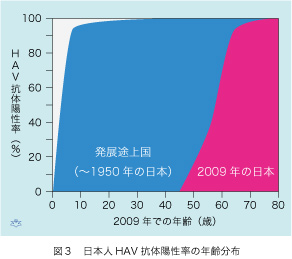 でも、これで「めでたしめでたし」とはいかなかったのです。ワクチンが高価(2回分の価格が米国で60ドル、日本では1万6千円)で、発展途上国には普及できにくい事情があります。継代培養を繰り返すことによって、毒性は失ったが増殖力を保持するHAVが得られれば、ポリオのように生ワクチンが製造できます。ごく少量のHAVですみますから、培養細胞で得られる多量のウイルス粒子を使うよりはずっと費用が安くなります。しかしHAVの生ワクチンは予防効率が悪く、中国でしか使われていません。HAV感染密度が高いアジアの一部とアフリカ、中南米の国々では、5歳までに国民のほぼ全員がHAVに感染し、終戦直後の日本が置かれた状況はこれと同じでした(図3)。衛生の改善(飲用水の塩素消毒と水洗便所の普及)に伴って、先進国ではHAV感染の頻度が減少しました。その結果、1950年代以後に出生した戦後世代の日本人ではHAV感染率が殆どゼロにまで低下したのです。しかし、これがいま新たな問題を提起しています。
でも、これで「めでたしめでたし」とはいかなかったのです。ワクチンが高価(2回分の価格が米国で60ドル、日本では1万6千円)で、発展途上国には普及できにくい事情があります。継代培養を繰り返すことによって、毒性は失ったが増殖力を保持するHAVが得られれば、ポリオのように生ワクチンが製造できます。ごく少量のHAVですみますから、培養細胞で得られる多量のウイルス粒子を使うよりはずっと費用が安くなります。しかしHAVの生ワクチンは予防効率が悪く、中国でしか使われていません。HAV感染密度が高いアジアの一部とアフリカ、中南米の国々では、5歳までに国民のほぼ全員がHAVに感染し、終戦直後の日本が置かれた状況はこれと同じでした(図3)。衛生の改善(飲用水の塩素消毒と水洗便所の普及)に伴って、先進国ではHAV感染の頻度が減少しました。その結果、1950年代以後に出生した戦後世代の日本人ではHAV感染率が殆どゼロにまで低下したのです。しかし、これがいま新たな問題を提起しています。
A型急性肝炎の経過と年齢が肝炎の発症に及ぼす影響
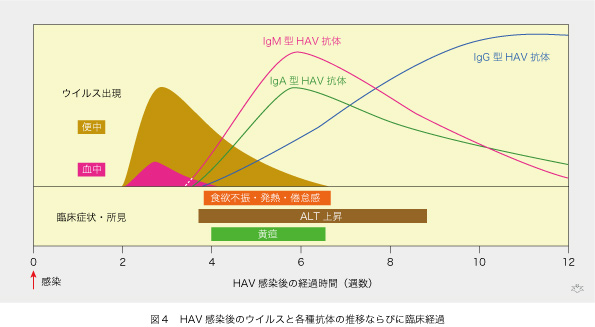
HAVに感染した後の経過は図4のようになります。感染してから二週間後にHAVが便中と血中に出現します。HAVは便あるいは血液から核酸を抽出し、ウイルス遺伝子(HAV RNA)をポリメラーゼ連鎖反応(polymerase chain reaction [PCR])で増幅した後に検出します。便中のHAVは血中より遙かに多量で、しかも長期間持続します。抗体の種類によって出現時期と推移に違いがあり、これによって急性HAV感染を過去の一過性感染から区別できます。IgM型とIgA型のHAV抗体は早く出現して感染後6週には最高値に達し、その後速やかに減衰します。ですから急性HAV感染の指標になります。IgG型HAV抗体はやや遅れて出現し緩やかに上昇して、感染後10〜12週で最高値に達します。そして、IgG型HAV抗体は生涯に亘って持続するので、終生免疫が得られます。黄疸と食欲不振、発熱などの臨床症状は感染後4〜6週にわたって現れます。肝機能の指標となるALT(GPTとも云います)の上昇は、臨床症状が消失した後も数週間つづきます。
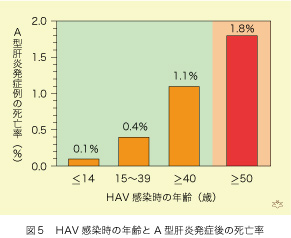 A型肝炎の発症率は感染時の年齢に相関します。5歳以下の感染では黄疸の発症率は25%に止まりますが、60歳以上ではこれが75%に上昇します。肝炎を発症した例での死亡率(case-fatality rate)は14歳以下で0.1%に止まりますが、年齢と共に上昇して、40歳以上では1.1%になります。別の調査でも、50歳以上の発症後死亡率は1.8%にも及んでいます(図5)。単純計算で18倍の差ですが、若年者の多くが臨床症状を伴わず、従って診断することができない不顕性感染であることを考えに入れますと、実質の差は50倍近くあるでしょう。日本で第二次世界大戦以前には、全国民が5歳までにHAVに感染しましたので、症状を伴う急性肝炎とそれによる死亡率は低く抑えられていました。適切な例えではありませんが、先進国では20世紀半ばまで自然の摂理による「A型肝炎生ワクチン」が、健康維持のため効果的に作動していたのではないでしょうか。現在でも、発展途上国ではこれが有効に機能しています。
A型肝炎の発症率は感染時の年齢に相関します。5歳以下の感染では黄疸の発症率は25%に止まりますが、60歳以上ではこれが75%に上昇します。肝炎を発症した例での死亡率(case-fatality rate)は14歳以下で0.1%に止まりますが、年齢と共に上昇して、40歳以上では1.1%になります。別の調査でも、50歳以上の発症後死亡率は1.8%にも及んでいます(図5)。単純計算で18倍の差ですが、若年者の多くが臨床症状を伴わず、従って診断することができない不顕性感染であることを考えに入れますと、実質の差は50倍近くあるでしょう。日本で第二次世界大戦以前には、全国民が5歳までにHAVに感染しましたので、症状を伴う急性肝炎とそれによる死亡率は低く抑えられていました。適切な例えではありませんが、先進国では20世紀半ばまで自然の摂理による「A型肝炎生ワクチン」が、健康維持のため効果的に作動していたのではないでしょうか。現在でも、発展途上国ではこれが有効に機能しています。
1995年に米国でMerck社製(VAQTA)とGlaxoSmithKline社製(Havrix)のHAVワクチンが同時に認可されました。最大のHAV貯蔵所は幼児なので、若年者を主な対象として米国とイスラエルでHAVワクチンが開始されました。しかし、その結果としてHAV抗体を持たない中間年齢層の人口が増加しました。そのためにHAV感染者の年齢層が若年から高年齢へと相対的に移行しました。これに伴って、症状が強い急性肝炎の頻度が次第に増加したのです。
A型肝炎ワクチンと免疫グロブリンによるHAV感染の予防
HAV感染の予防法には二通りあります。一つはA型肝炎ワクチンです。接種を受けた人が自分でHAV抗体をつくりますから能動免疫とよばれ、抗体は長期間持続します。もう一つはA型肝炎免疫グロブリンで、過去にHAV感染しIgG型HAV抗体価が高いドナーの血漿から精製します。単に抗体を貰うだけなので、受動免疫と云われます。免疫グロブリンの血清中濃度は、注射してから20日ごとに半分になります。2ヶ月で8分の1、6ヶ月後には512分の1となる計算になります。A型肝炎ワクチンの開発直後に、米国で感染頻度が高い児童を対象として予防効果が検討されました(図6)。ワクチンを接種した519名とワクチンの代わりに偽薬(プラセボ)を注射した児童518名を140日(約5ヶ月)にわたって追跡し、それぞれの群で急性A型肝炎の発症頻度を調べたのです。学校が同じですので、全員に同じようなHAV感染リスクがあると想定できます。ワクチン接種児童と非接種児童のHAV感染頻度には約4倍の差がありました(1.3%対5.4%)。注目すべきことに、ワクチンを接種してもA型肝炎を発症した児童7名は、全員が接種後17日以内に発症し、20日以後の発症はありませんでした。そして、ワクチン接種後のA型肝炎の症状は、非接種児童の症状よりずっと軽かったのです。以上の結果から、ワクチンのHAV感染予防効果は接種後17日以後に発揮されること、そして感染後にワクチンを接種しても肝炎の症状を軽くする効果があることが分かります。

A型肝炎ワクチンは、2回接種します。第一回ワクチン接種後、血清中のHAV抗体価は3ヶ月で頭打ちとなります(図7)。4〜6週後に第二回ワクチンを接種するとHAV抗体価は飛躍的に上昇し、ブースター効果が認められます。抗体価は血清1ミリリットルあたりのミリ単位(1単位の千分の1すなわち [mU/mL])で表します。この図は対数目盛ですので、血清1ミリリットルあたり200 mIU/mLから10,000 mU/mLへと50倍も増加しています。ワクチンのHAV感染予防効果(20 mU/mL以上が有効と考えられています)は25年から30年続くと考えられていますが、恐らくそれより長いでしょう。抗体が消失しても免疫記憶がありますから、生涯にわたってA型肝炎を発症する危険性を防御できると予想できます。 |
 |
|
|
||
| 一方、A型肝炎免疫グロブリン注射後には、HAV抗体が時間と共に減少します(図8)。3ヶ月後には抗体濃度が予防効果のある20 mU/mL近辺まで減ってしまいますが、測定できない微量のHAV抗体があっても有効なので、それ以後もある期間は感染を予防できます。しかし、やがては完全に消失しますからHAV感染の予防効果はなくなります。その上、免疫グロブリンの筋肉注射量が成人で10 mL、小児でも5 mLはありますから苦痛を伴います。免疫グロブリンの効果を持続させるためには注射を繰り返すことになりますから、この点ではワクチンがずっと優れています。しかし、抗体が産生されるまでに約2週間かかるワクチンとは違って、免疫グロブリンの感染防御効果は注射後直ちに現れます。ですから感染が既に起こっている場合には、即効性がある免疫グロブリンの方が、ワクチンより確実なHAV感染予防効果をもたらします。 | 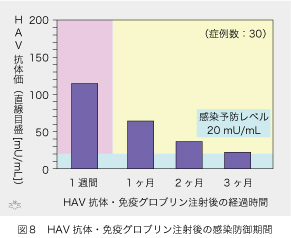 |
|
A型肝炎罹患の危険性と防御対策
 先進国では、症状が重くなる成人層でHAV感染の危険性が増加しています。HAV感染勃発(アウトブレイク)は、汚染された飲料水と食物の摂取によって媒介されます。1988年に上海で発生し、30万人以上が罹患したHAV感染は、十分に火が通っていない二枚貝の摂食が原因でした(表1)。摂食者の4.3%に肝炎が発症し、40名が劇症肝炎で死亡したのです。中国の都会では1995年から生ワクチンが普及する以前にも、経済発展による衛生環境の改善(上下水道の整備)によって、米国と日本並みの年齢別・HAV抗体分布となっていたので、このように悲惨な結果となりました。
先進国では、症状が重くなる成人層でHAV感染の危険性が増加しています。HAV感染勃発(アウトブレイク)は、汚染された飲料水と食物の摂取によって媒介されます。1988年に上海で発生し、30万人以上が罹患したHAV感染は、十分に火が通っていない二枚貝の摂食が原因でした(表1)。摂食者の4.3%に肝炎が発症し、40名が劇症肝炎で死亡したのです。中国の都会では1995年から生ワクチンが普及する以前にも、経済発展による衛生環境の改善(上下水道の整備)によって、米国と日本並みの年齢別・HAV抗体分布となっていたので、このように悲惨な結果となりました。
2003年にフィラデルフィアの某レストランで勃発したHAV感染は、汚染された野菜(グリーン・オニオン)が原因でした。僅か数日間ですが、客の全員にサービスでサラダとして提供されたのです。摂食者の6.2%に相当する、601名が急性肝炎に罹患し124名が入院しました。4名が劇症肝炎となり1名だけ肝移植を受けて救命されました。1997年にミシガン州とメイン州の学童に集団発生したHAV感染はメキシコから輸入した冷凍イチゴが原因でした。罹患者が9歳から13歳までの若齢だったので症状が比較的かるく、幸いに死亡例はありませんでした。
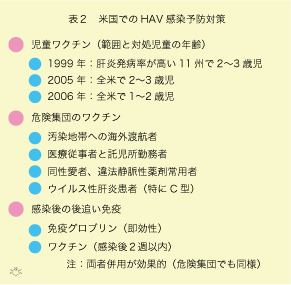 米国では、一般社会の感染危険を減らすため次々に手が打たれてきました(表2)。ターゲットはHAVの貯蔵所となっている幼児でした。無症候性感染が殆どですが、そのために便中HAV排泄期間が長くなります。その上、幼児は成人と比べて衛生面の配慮を怠りがちですから、どうしても感染が拡大してしまいます。原因不明の散発性A型肝炎患者の約半数に6歳以下の家族がいたので、児童が感染源であった可能性があります。1999年代には全米のHAV感染罹病率は10万人中10人でした。その2倍に相当する罹病率が10万人中20人以上ある西海岸、メキシコ付近の11州で生後24ヶ月から35ヶ月までの幼児を対象としてA型肝炎ワクチン接種が開始され、2005年にはそれが全米に拡大されました。そして、2006年以来は全米で生後12ヶ月から23ヶ月までの全幼児に集団ワクチン接種が行われるようになりました。
米国では、一般社会の感染危険を減らすため次々に手が打たれてきました(表2)。ターゲットはHAVの貯蔵所となっている幼児でした。無症候性感染が殆どですが、そのために便中HAV排泄期間が長くなります。その上、幼児は成人と比べて衛生面の配慮を怠りがちですから、どうしても感染が拡大してしまいます。原因不明の散発性A型肝炎患者の約半数に6歳以下の家族がいたので、児童が感染源であった可能性があります。1999年代には全米のHAV感染罹病率は10万人中10人でした。その2倍に相当する罹病率が10万人中20人以上ある西海岸、メキシコ付近の11州で生後24ヶ月から35ヶ月までの幼児を対象としてA型肝炎ワクチン接種が開始され、2005年にはそれが全米に拡大されました。そして、2006年以来は全米で生後12ヶ月から23ヶ月までの全幼児に集団ワクチン接種が行われるようになりました。
1995年には全米で年間に31,582例のA型肝炎が報告されましたが、発症者はこの2〜3倍で、不顕性を含めた感染者は約10倍の30万人いた、と推計されています。1999年から開始され次第に対象が拡大した幼児のワクチン接種によってHAVの貯蔵所(感染源)が縮小し、その結果として成人の感染率も減少しました。2005年には年間のA型肝炎発症数が4,488例へと、7分の1以下にも減少したのです。平行して危険集団のワクチン接種も行われています。最大の危険集団は海外旅行者で、HAV感染率の高い国々(図2をご覧下さい)に滞在すると、高頻度(200人中1人 [0.5%]) で感染します。高級ホテルに滞在してもHAV感染の危険性があり、感染者の半数が小児です。出発の4週以前に2回のワクチン接種が必要とされ、間に合わなければ免疫グロブリンを併用します。託児所(特におむつ着用児)の職員と医療従事者もHAV感染の危険が高く、ワクチン接種が勧められます。同性愛者と違法静脈性薬剤使用者にも、HAV感染の危険があります。慢性肝炎患者がHAVに感染すると、特にC型肝炎患者では重症化しやすいことが知られています。しかし、肝炎患者のワクチン接種率は、まだ低いようです。
今後のHAV感染予防対策
振り返って、日本でHAV感染規模の把握と予防対策はどうなっているか、気になってきます。海外旅行者にワクチン接種が勧められていますが、ネパールに渡航した日本人旅行者のA型肝炎ワクチン接種率は僅かに5%で、ヨーロッパ人とオーストラリア人の95%と比べて、あまりにもお粗末な実施状況でした。その上、日本では規則によって16歳以上がA型肝炎ワクチン接種の対象になっています。ワクチンの使用適応のためのようです。幼児が感染しやすく、潜伏期間が15日から時として50日もあるので、海外からHAVを持ち込む可能性はないでしょうか? 幼児集団ワクチンの気配も未だありません。最近は幸いにして感染勃発の報告がありませんが、将来もそれが続く保証はありません。
危険集団のワクチン接種と平行して、本邦HAV感染の実態把握も先決です。2005年A型急性肝炎の報告数が米国の4,488例と比べて日本は170例(2006年でも320例)ですから約5%に過ぎず、あまりにも少ないことが気になります。これを根拠に安心していては、危ないかもしれません。米国では、報告例以外に発症例がその2〜3倍あると予測され、更に背後に報告しようがない不顕性感染例が10倍ある、と推測されています。それに準じますと、日本のA型急性肝炎発症例もずっと多くなり、米国の水準に近づきます。そして、その背後に年間1万人レベルの不顕性感染例が潜んでいることになります。
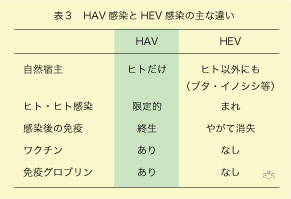 HAV感染の対策はHEV感染より、はるかにやりやすいのです。HAVの自然宿主はヒトだけで、感染ルートはヒトからヒトに限定されます(表3)。従って、ヒトのHAV感染を根絶できれば、天然痘のように全世界から病原体を排除することができます。HEVではヒトに加えて肥育ブタと野生動物も感染していますから、感染を根絶することは困難です。HAV感染後の免疫は生涯続きますが、HEV感染後の中和抗体は長続きしません。HAVはワクチンがあり、免疫予防は恐らく一生持続しますが、HEVに対するワクチンはなく、たとえ製造できても予防効果は一定期間に限られるでしょう。たとえHAVに感染してしまってからでも、2週間以内であれば免疫グロブリンによって感染を未然に防ぐことができます。このような背景事情からも、日本でHAV感染対策を真剣に考える時期がきているように考えられます。
HAV感染の対策はHEV感染より、はるかにやりやすいのです。HAVの自然宿主はヒトだけで、感染ルートはヒトからヒトに限定されます(表3)。従って、ヒトのHAV感染を根絶できれば、天然痘のように全世界から病原体を排除することができます。HEVではヒトに加えて肥育ブタと野生動物も感染していますから、感染を根絶することは困難です。HAV感染後の免疫は生涯続きますが、HEV感染後の中和抗体は長続きしません。HAVはワクチンがあり、免疫予防は恐らく一生持続しますが、HEVに対するワクチンはなく、たとえ製造できても予防効果は一定期間に限られるでしょう。たとえHAVに感染してしまってからでも、2週間以内であれば免疫グロブリンによって感染を未然に防ぐことができます。このような背景事情からも、日本でHAV感染対策を真剣に考える時期がきているように考えられます。
参考文献
Feinstone SM, Kapikian AZ, Purceli RH: Hepatitis A: detection by immune electron microscopy of a viruslike antigen associated with acute illness. Science 1973;182:1026-1028.
Provost PJ, Hilleman MR: Propagation of human hepatitis A virus in cell culture in vitro. Proc Soc Exp Biol Med 1979;160:213-221.
Werzberger A, Mensch B, Kuter B, Brown L, Lewis J, Sitrin R, Miller W, Shouval D, Wiens B, Calandra G, et al.: A controlled trial of a formalin-inactivated hepatitis A vaccine in healthy children. N Engl J Med 1992;327:453-457.
Shouval D, Ashur Y, Adler R, Lewis JA, Miller W, Kuter B, Brown L, Nalin DR: Safety, tolerability, and immunogenicity of an inactivated hepatitis A vaccine: effects of single and booster injections, and comparison to administration of immune globulin. J Hepatol 1993;18:S32-37.
Halliday ML, Kang LY, Zhou TK, Hu MD, Pan QC, Fu TY, Huang YS, Hu SL: An epidemic of hepatitis A attributable to the ingestion of raw clams in Shanghai, China. J Infect Dis 1991;164:852-859.
Wheeler C, Vogt TM, Armstrong GL, Vaughan G, Weltman A, Nainan OV, Dato V, Xia G, Waller K, Amon J, Lee TM, Highbaugh-Battle A, Hembree C, Evenson S, Ruta MA, Williams IT, Fiore AE, Bell BP: An outbreak of hepatitis A associated with green onions. N Engl J Med 2005;353:890-897.
Hutin YJ, Pool V, Cramer EH, Nainan OV, Weth J, Williams IT, Goldstein ST, Gensheimer KF, Bell BP, Shapiro CN, Alter MJ, Margolis HS: A multistate, foodborne outbreak of hepatitis A. National Hepatitis A Investigation Team. N Engl J Med 1999;340:595-602.
Hepatitis A vaccination coverage among children aged 24-35 months _ United States, 2004-2005. MMWR Morb Mortal Wkly Rep 2007;56:678-681.
Update: Prevention of hepatitis A after exposure to hepatitis A virus and in international travelers. Updated recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2007;56:1080-1084.
Basnyat B, Pokhrel G, Cohen Y: The Japanese need travel vaccinations. J Travel Med 2000;7:37.
![]()