
現在肝細胞癌のために死亡される方々が年間で約3万5千人もいます。1975年以来増加を続け、ようやく頭打ちになりましたが、この状態は数年持続し、やがては減少すると予測されています。原因はC型肝炎ウイルス([HCV])が約80%でB型肝炎ウイルス(HBV)が14%、他はアルコール性および原因不明の肝硬変(非アルコール性脂肪性肝炎など)です。殆どの症例で、背景に進展した肝硬変がありますがHBV感染患者だけは肝硬変に進展する以前の慢性肝炎、あるいは肝臓に炎症がなくても、肝細胞癌を発症することがあります。これは、ウイルス遺伝子(HBV DNA)が肝細胞の染色体に組み込まれることが原因です。肝炎ウイルスは肝臓に炎症を起し、これに対する細胞性免疫反応が肝細胞を死滅させます。線維化によって炎症は修復されますが進行すれば肝硬変となります。組織も再生し肝細胞が増殖するので、これに伴って肝細胞の過形成が起こり、一部の症例では肝細胞が自立的に増殖して肝細胞癌が発生します。ですから、HCVあるいはHBVに感染している方々には、定期的に血清中の腫瘍マーカーと腹部の画像診断を行って、肝細胞癌を早期に診断する必要があります(詳しくは第四話をごらんください)。
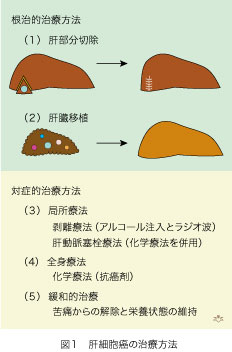 肝細胞癌が発見されたときに、色々な治療方法があります(図1)。大きく分けて根治的治療方法と対症的治療方法がありますが、境界は必ずしも明確ではありません。肝細胞癌の数が少なくて(たとえば一個だけ)場所が肝臓の辺縁にありアクセスしやすい場合には、外科的に切除することが可能です。肝硬変があっても軽症で肝機能が保たれていること、肝細胞癌の転移がないことが切除による根治の条件となりますので、適応は約30%に限られます。腫瘍の再発も多く術後5年の生存率は25%〜45%に止まります。最良の適応は、肝障害が軽度なHBV感染患者に発症する肝細胞癌で、予後も良好です。しかしHCV感染患者の肝細胞癌は殆どが肝硬変になってから発症しますので、肝機能の予備力は低下しています。その上、肝細胞の壊死と再生が繰り返される結果として、肝細胞癌が1個だけではなく「多中心性」に複数発症することが特徴です。たとえ超音波、コンピュータ断層撮影(CT)と磁気共鳴画像(MRI)で発見されなくても見落とされた肝細胞癌が、他にもあるかも知れません。この場合に肝細胞癌を含む、肝硬変となった肝臓を全部取ってしまい、新しい肝臓に入れかえれば肝細胞癌の治療だけでなく、肝硬変の治療にもなりますので一挙両得です。このために、進行した肝硬変に発症した肝細胞癌症例では、肝移植が唯一の究極的治療法となります。
肝細胞癌が発見されたときに、色々な治療方法があります(図1)。大きく分けて根治的治療方法と対症的治療方法がありますが、境界は必ずしも明確ではありません。肝細胞癌の数が少なくて(たとえば一個だけ)場所が肝臓の辺縁にありアクセスしやすい場合には、外科的に切除することが可能です。肝硬変があっても軽症で肝機能が保たれていること、肝細胞癌の転移がないことが切除による根治の条件となりますので、適応は約30%に限られます。腫瘍の再発も多く術後5年の生存率は25%〜45%に止まります。最良の適応は、肝障害が軽度なHBV感染患者に発症する肝細胞癌で、予後も良好です。しかしHCV感染患者の肝細胞癌は殆どが肝硬変になってから発症しますので、肝機能の予備力は低下しています。その上、肝細胞の壊死と再生が繰り返される結果として、肝細胞癌が1個だけではなく「多中心性」に複数発症することが特徴です。たとえ超音波、コンピュータ断層撮影(CT)と磁気共鳴画像(MRI)で発見されなくても見落とされた肝細胞癌が、他にもあるかも知れません。この場合に肝細胞癌を含む、肝硬変となった肝臓を全部取ってしまい、新しい肝臓に入れかえれば肝細胞癌の治療だけでなく、肝硬変の治療にもなりますので一挙両得です。このために、進行した肝硬変に発症した肝細胞癌症例では、肝移植が唯一の究極的治療法となります。
再発を防ぐために、癌細胞の血管内およびリンパ管内への浸潤がなく、他臓器(肺、骨など)への転移がないことが前提となります。肝臓は門脈を介して、他臓器癌(胃癌、大腸癌など)からの転移が多い宿命にありますが、逆に肝細胞癌は進行するまで他臓器に転移することは少ないのです。ですから、肝細胞癌がある肝臓を入れかえる肝移植が理想的な治療法となります。
対症的治療法の最右翼に、近年ますます改良を続けている局所療法があります。肝細胞癌に針を刺して薬物(アルコールなど)あるいは加熱(ラジオ波)によって癌細胞を死滅させる剥離療法です。勿論、他に病巣がなければ根治方法となります。肝細胞癌は肝動脈から栄養の供給を受けているので、ゼラチンスポンジ等によって肝動脈を塞ぐことで肝細胞癌を壊死させる、経カテーテル肝動脈塞栓療法(transcatheter arterial embolization [TAE])が有効で、進行性肝細胞癌の治療に使われています。進行性で他臓器に転移がある症例では、全身療法として抗癌剤が使用され、苦痛をとり全身状態を保持するための緩和的治療も行われます。
肝細胞癌の肝移植療法変遷とミラノ基準の登場
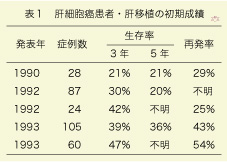 脳死患者からの死体肝移植は、1967年に米国で初めて行われました。当初は、新生児の胆管閉塞と代謝性肝疾患が主な適応でしたが、1990年代になると肝細胞癌患者を対象とした究極の治療法として多くの施設で行われました。しかし初期の肝細胞癌肝移植療法の成績は、とても満足できるものではありませんでした(表1)。3年および5年生存率で判断される長期予後が50%にも満たず、再発率がとても高かったのです。そのために、「肝細胞癌治療には肝移植の適応がない」と考えられました。これは、肝細胞癌が進行し転移がある症例に肝移植が行われることが多かった事が原因です。すなわち転移がない初期の肝細胞癌症例に肝移植を施行しないと、根治療法にならないことが判明したのです。これは至極当然と云えますが、難しい問題をはらんでいます。全ての悪性腫瘍と同様に肝細胞癌も早期診断と早期治療が望まれますが、小さな単発癌に肝移植を施行した症例では、摘出した肝臓に肝細胞癌が存在しないことが、20%から30%もあったのです。死体肝ドナーは数も限られ、移植を待機している患者さんが多数いますので、実際に移植を受けられるのは4分の1にすぎません。肝細胞癌の全症例には早期治療ができないので、肝移植が有効である症例を選ぶ必要が生じました。
脳死患者からの死体肝移植は、1967年に米国で初めて行われました。当初は、新生児の胆管閉塞と代謝性肝疾患が主な適応でしたが、1990年代になると肝細胞癌患者を対象とした究極の治療法として多くの施設で行われました。しかし初期の肝細胞癌肝移植療法の成績は、とても満足できるものではありませんでした(表1)。3年および5年生存率で判断される長期予後が50%にも満たず、再発率がとても高かったのです。そのために、「肝細胞癌治療には肝移植の適応がない」と考えられました。これは、肝細胞癌が進行し転移がある症例に肝移植が行われることが多かった事が原因です。すなわち転移がない初期の肝細胞癌症例に肝移植を施行しないと、根治療法にならないことが判明したのです。これは至極当然と云えますが、難しい問題をはらんでいます。全ての悪性腫瘍と同様に肝細胞癌も早期診断と早期治療が望まれますが、小さな単発癌に肝移植を施行した症例では、摘出した肝臓に肝細胞癌が存在しないことが、20%から30%もあったのです。死体肝ドナーは数も限られ、移植を待機している患者さんが多数いますので、実際に移植を受けられるのは4分の1にすぎません。肝細胞癌の全症例には早期治療ができないので、肝移植が有効である症例を選ぶ必要が生じました。
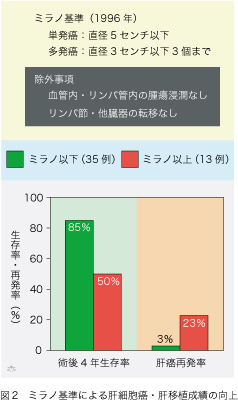 1996年になって、イタリアのミラノにある肝移植チームが、この問題に画期的な回答を提供しました。以来これが「ミラノ基準」として、あまねく全世界で適用され、肝細胞癌肝移植の治療成績を大幅に向上させました(図2)。48例の肝細胞癌症例に死体肝移植を施行して、摘出肝で調べた肝細胞癌の大きさと数が患者の予後と対比されました。その結果:(1)単発癌であれば直径が5センチ以下;(2)多発癌であれば、すべて直径が3センチ以下で数は3個まで、とする基準(すなわち「ミラノ基準」)を満たす症例は、それを超える症例よりも遙かに予後がよいことが分かったのです。勿論、血管とリンパ管内への腫瘍細胞浸潤と、リンパ節および他臓器に転移がないことが、前提条件となります。ミラノ基準を満たす35例と基準を超えた13例を比較しますと、4年生存率は85%対50%で、統計学的にも有意な差がみられます。しかし、ミラノ基準も問題なしとはしません。摘出肝の腫瘍を病理学的に検査していますが、手術以前には画像診断でしか腫瘍の直径と数を調べることができないのです。実際に、画像診断によってミラノ基準内にあった症例の中で、摘出肝を調べてみるとミラノ基準を超えていた例が27%もありました。ですから、これを絶対基準として採用するには、もともと無理があります。しかし、その後の肝細胞癌肝移植の治療成績は、全てミラノ基準の有用性と妥当性を支持するものばかりでした。そのためにミラノ基準が、世界中で黄金律(gold standard)として汎用されています。
1996年になって、イタリアのミラノにある肝移植チームが、この問題に画期的な回答を提供しました。以来これが「ミラノ基準」として、あまねく全世界で適用され、肝細胞癌肝移植の治療成績を大幅に向上させました(図2)。48例の肝細胞癌症例に死体肝移植を施行して、摘出肝で調べた肝細胞癌の大きさと数が患者の予後と対比されました。その結果:(1)単発癌であれば直径が5センチ以下;(2)多発癌であれば、すべて直径が3センチ以下で数は3個まで、とする基準(すなわち「ミラノ基準」)を満たす症例は、それを超える症例よりも遙かに予後がよいことが分かったのです。勿論、血管とリンパ管内への腫瘍細胞浸潤と、リンパ節および他臓器に転移がないことが、前提条件となります。ミラノ基準を満たす35例と基準を超えた13例を比較しますと、4年生存率は85%対50%で、統計学的にも有意な差がみられます。しかし、ミラノ基準も問題なしとはしません。摘出肝の腫瘍を病理学的に検査していますが、手術以前には画像診断でしか腫瘍の直径と数を調べることができないのです。実際に、画像診断によってミラノ基準内にあった症例の中で、摘出肝を調べてみるとミラノ基準を超えていた例が27%もありました。ですから、これを絶対基準として採用するには、もともと無理があります。しかし、その後の肝細胞癌肝移植の治療成績は、全てミラノ基準の有用性と妥当性を支持するものばかりでした。そのためにミラノ基準が、世界中で黄金律(gold standard)として汎用されています。
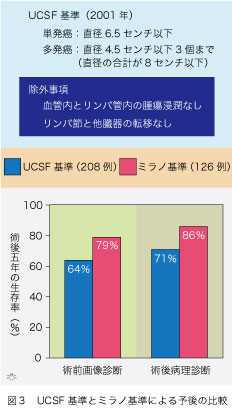 ミラノ基準を満たさない肝細胞癌症例の中にも肝移植によって大いに恩恵を受ける例があることは明らかです。実際に、ミラノ基準外の症例ですら肝移植後4年生存率が50%もあるのです。ミラノ基準があまりにも厳しすぎるので、これを緩めて適応を拡大する試みが、方々で行われました。代表的な一つとして、2001年にカリフォルニア大学サンフランシスコ分校(University of California San Francisco)の移植チームが提唱したUCSF基準があります(図3)。単発癌では腫瘍の直径が6.5センチ以下で多発癌であればいずれも直径4.5センチ以下で数は3個まで、そして直径の合計が8センチ以下、と細かく規定されています。僅かですがミラノ基準が拡大され、その結果肝移植を受けられる肝細胞癌症例が増加しました。勿論、ミラノ基準と同様な除外事項があります。20年以上にわたり肝移植療法をうけた肝細胞癌症例の中でUCSF基準とミラノ基準を満たした例の術後5年生存率に統計学的な有意差がなかったので、ミラノ基準をUCSF基準にまで拡大できる、と結論されています。しかし統計学的有意差がないとはいえ、UCSF基準の方がミラノ基準より、術前の画像診断でも(64%対79%)摘出肝の病理診断でも(71%対86%)、5年間の生存率は劣っています。
ミラノ基準を満たさない肝細胞癌症例の中にも肝移植によって大いに恩恵を受ける例があることは明らかです。実際に、ミラノ基準外の症例ですら肝移植後4年生存率が50%もあるのです。ミラノ基準があまりにも厳しすぎるので、これを緩めて適応を拡大する試みが、方々で行われました。代表的な一つとして、2001年にカリフォルニア大学サンフランシスコ分校(University of California San Francisco)の移植チームが提唱したUCSF基準があります(図3)。単発癌では腫瘍の直径が6.5センチ以下で多発癌であればいずれも直径4.5センチ以下で数は3個まで、そして直径の合計が8センチ以下、と細かく規定されています。僅かですがミラノ基準が拡大され、その結果肝移植を受けられる肝細胞癌症例が増加しました。勿論、ミラノ基準と同様な除外事項があります。20年以上にわたり肝移植療法をうけた肝細胞癌症例の中でUCSF基準とミラノ基準を満たした例の術後5年生存率に統計学的な有意差がなかったので、ミラノ基準をUCSF基準にまで拡大できる、と結論されています。しかし統計学的有意差がないとはいえ、UCSF基準の方がミラノ基準より、術前の画像診断でも(64%対79%)摘出肝の病理診断でも(71%対86%)、5年間の生存率は劣っています。
基準を厳しくすれば当然ながら予後はよくなりますが程度の差だけで、はっきりとした境界線を引きにくいことが分かります。腫瘍の大きさと数を揃えても、患者さんによって悪性度が違えば、個人差があるはずです。腫瘍の数よりはサイズの方が重要である、とも考えられています。画像診断で腫瘍を全て描出することは所詮不可能ですので摘出肝に新たな腫瘍が発見されても当然です。すなわち術前の腫瘍数を限定することには、無理があります。一方腫瘍の大きさは顕微鏡で判断される微少な血管とリンパ管内への癌細胞浸潤に関係します。直径4センチまでの腫瘍には殆どなく、大きさが増すにつれて血管内とリンパ管への腫瘍細胞浸潤の可能性が増大すると考えらています。実際に腫瘍の直径が5センチを超えなければ、数は10個かそれ以上あっても構わないと考える術者もいて、ミラノ基準に匹敵する術後成績をあげています。
肝移植手術数の経年増加 日本と米国の比較
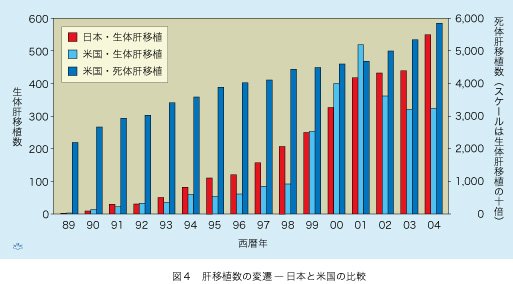 脳死患者からの死体肝移植は欧米で広く行なわれてきましたが、東洋では倫理的および宗教的見地から、避けられる風潮が強いようです。肝移植の症例数は、日米とも年と共に増加し続けています(図4)。米国では死体肝移植が圧倒的に多く、年間6千例に及び総数は7万例に届き一国だけでヨーロッパの全症例数をも凌駕しています。米国では今やC型慢性肝疾患が、最大の肝移植適応で、50%にも届こうとしています。国民の約3百万人がHCVに持続感染し、今後の十年間に50〜80万人が移植待機リストに登録される見通しだそうです。現時点で移植待機患者が2万人近く登録され、年間9千人がこれに加わります。移植を受けられるのは6千例に過ぎないので、待機中に死亡する例が増加しています。この状況を打開するべく1990年代以来、親族と配偶者からの生体肝移植が行なわれるようになりました。数は増加し続けましたが、ドナーの死亡例が発生したために、米国では2001年を境として減少傾向にあります。
脳死患者からの死体肝移植は欧米で広く行なわれてきましたが、東洋では倫理的および宗教的見地から、避けられる風潮が強いようです。肝移植の症例数は、日米とも年と共に増加し続けています(図4)。米国では死体肝移植が圧倒的に多く、年間6千例に及び総数は7万例に届き一国だけでヨーロッパの全症例数をも凌駕しています。米国では今やC型慢性肝疾患が、最大の肝移植適応で、50%にも届こうとしています。国民の約3百万人がHCVに持続感染し、今後の十年間に50〜80万人が移植待機リストに登録される見通しだそうです。現時点で移植待機患者が2万人近く登録され、年間9千人がこれに加わります。移植を受けられるのは6千例に過ぎないので、待機中に死亡する例が増加しています。この状況を打開するべく1990年代以来、親族と配偶者からの生体肝移植が行なわれるようになりました。数は増加し続けましたが、ドナーの死亡例が発生したために、米国では2001年を境として減少傾向にあります。
 1989年から2004年までの15年間に米国で行なわれた生体肝移植症例は2,639例で、死体肝移植65,898症例の4%に過ぎません。同期間に日本では3,129例の生体肝移植が行われ、年と共に順調に症例数が増えています。この間、日本の死体肝移植症例は僅か26例に過ぎませんので、生体と死体肝移植の比較は米国でしか出来ません。生体肝移植は死体肝移植と比べて、いくつかの利点と欠点があります(表2)。最大の利点は移植待機時間が存在しないことです。主に親族のドナーで、たとえ多大な犠牲を払っても患者を助けたい、という尊い意思があるからです。更にまた、移植手術とドナーの部分肝切除を、同一施設で計画的に施行できますから、死体肝移植と比べて移植肝の虚血時間が大幅に短縮されます。また、近年ますます高齢化している脳死ドナーと比べて、生体肝移植ドナーは若年で肥満者が少ないので、肝脂肪症(steatosis)の頻度が低くなります。結果として生体肝移植では生きの良い新鮮な肝臓を、望みうる最良のタイミングで移植することが可能となります。
1989年から2004年までの15年間に米国で行なわれた生体肝移植症例は2,639例で、死体肝移植65,898症例の4%に過ぎません。同期間に日本では3,129例の生体肝移植が行われ、年と共に順調に症例数が増えています。この間、日本の死体肝移植症例は僅か26例に過ぎませんので、生体と死体肝移植の比較は米国でしか出来ません。生体肝移植は死体肝移植と比べて、いくつかの利点と欠点があります(表2)。最大の利点は移植待機時間が存在しないことです。主に親族のドナーで、たとえ多大な犠牲を払っても患者を助けたい、という尊い意思があるからです。更にまた、移植手術とドナーの部分肝切除を、同一施設で計画的に施行できますから、死体肝移植と比べて移植肝の虚血時間が大幅に短縮されます。また、近年ますます高齢化している脳死ドナーと比べて、生体肝移植ドナーは若年で肥満者が少ないので、肝脂肪症(steatosis)の頻度が低くなります。結果として生体肝移植では生きの良い新鮮な肝臓を、望みうる最良のタイミングで移植することが可能となります。
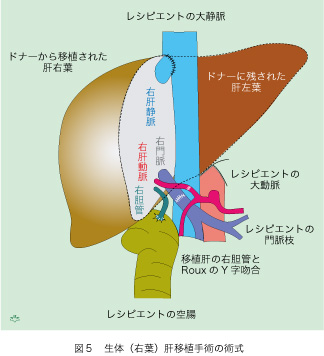 生体肝移植で最大の欠点は、ドナーの負担が大きいことです。個人の治療を目的としない、健常者が受ける唯一の外科手術である、肝部分切除の対象となるからです。通常は肝臓の約60%を占める右葉が患者さんに提供され、左葉がドナーに残されます(図5)。摘出された肝右葉にある三系統の血管(肝静脈、門脈と肝動脈)を、それぞれ患者(レシピエント)の対応血管と吻合し、右胆管は切断した小腸の断端と吻合します。それを切断後に連結された小腸と、Y字型に吻合します(有名な「RouxのY字吻合」と呼ばれる術式です)。大きな肝臓切断面が露出されますから、胆管小分枝からの胆汁流出は途絶します。結果として移植後の胆汁うっ滞は避けられませんから、稀に腹膜炎と感染症の原因となります。同じ理由で静脈うっ血も生じる可能性があり、血栓症が起これば還流領域の肝組織が働かないので、肝機能にも影響することになります。
生体肝移植で最大の欠点は、ドナーの負担が大きいことです。個人の治療を目的としない、健常者が受ける唯一の外科手術である、肝部分切除の対象となるからです。通常は肝臓の約60%を占める右葉が患者さんに提供され、左葉がドナーに残されます(図5)。摘出された肝右葉にある三系統の血管(肝静脈、門脈と肝動脈)を、それぞれ患者(レシピエント)の対応血管と吻合し、右胆管は切断した小腸の断端と吻合します。それを切断後に連結された小腸と、Y字型に吻合します(有名な「RouxのY字吻合」と呼ばれる術式です)。大きな肝臓切断面が露出されますから、胆管小分枝からの胆汁流出は途絶します。結果として移植後の胆汁うっ滞は避けられませんから、稀に腹膜炎と感染症の原因となります。同じ理由で静脈うっ血も生じる可能性があり、血栓症が起これば還流領域の肝組織が働かないので、肝機能にも影響することになります。
他の大きな差として移植肝のサイズがあります。フルサイズの肝臓が移植される死体肝移植と違って、生体肝移植では一つの肝臓をドナーと患者(レシピエント)との間で分かち合わなければならないので、当然のことです。
プロメテウスの肝臓
 時を遠く遡って、ギリシャ神話時代の物語があります。プロメテウスは「神々の神」であるゼウスの目を盗んで人間に火を与えました。それを知ったゼウスは立腹し、カウカソス山の岩壁に鎖で縛り付けました。そこに大鷲がきて、プロメテウスの肝臓を食べましたが、翌日になると肝臓は元通りに復元しました。そして、英雄ヘラクレスが救いにきて彼を解き放つ迄プロメテウスの苦難は毎日続いたのです。彼の名はpro + metheusで、先に考えることにちなんでいます。禁を犯し禍の箱(壺とも云われます)を開けてしまう悪妻パンドラを娶った愚弟のエピメテウス(後で考える人)とは違い人類の恩人で賢人でもあったのでしょう。現在でも、これが肝臓の強い再生力を記した最古の逸話として語り継がれています。
時を遠く遡って、ギリシャ神話時代の物語があります。プロメテウスは「神々の神」であるゼウスの目を盗んで人間に火を与えました。それを知ったゼウスは立腹し、カウカソス山の岩壁に鎖で縛り付けました。そこに大鷲がきて、プロメテウスの肝臓を食べましたが、翌日になると肝臓は元通りに復元しました。そして、英雄ヘラクレスが救いにきて彼を解き放つ迄プロメテウスの苦難は毎日続いたのです。彼の名はpro + metheusで、先に考えることにちなんでいます。禁を犯し禍の箱(壺とも云われます)を開けてしまう悪妻パンドラを娶った愚弟のエピメテウス(後で考える人)とは違い人類の恩人で賢人でもあったのでしょう。現在でも、これが肝臓の強い再生力を記した最古の逸話として語り継がれています。
肝細胞の数が減ると、肝細胞増殖因子(HGF)を始めとする諸種のタンパクが分泌されて細胞数を増加させますが、その絶大な速度と絶妙な調節力には驚かされます。とても人間業とは思えないので「神の摂理」なのでしょうか。生体肝移植のドナーでもレシピエントでも、肝細胞再生は素早く開始します。ドナーでは肝左葉の容積が僅か7日後には2倍となり、14日で術前の85%に増大し30日後には元通りになります。より大きい右葉を移植されたレシピエントの肝臓回復は更に速く、術後14日にはフルサイズとなります。調節力は見事というほかなく、体の大きさに従って体重の50分の1(2%)にまで成長した時点で肝細胞増殖はピタリと停止するのです。ドナーとレシピエントの肝臓復元力は驚異以外になく、お陰で生体肝移植は再生医療の筆頭に位置していますし強い復元力があるからこそ生体肝移植が可能なのです。
しかし、肝臓の強い増殖力にも限界があり、30%は残っていないと復元しません。正確には、体重の0.8%に相当する重量が必須とされています。大鷲は、プロメテウスの肝臓を毎日、全部は食べずに一部を残しておいたに違いありません。
肝細胞癌の生体肝移植療法の現状
死体肝移植数がまだとても少ない日本では生体肝移植だけが肝細胞癌の根治療法となります。2004年までに5百例近く行われ、生体肝移植全体(約3千例)の6分の1に相当します。費用として、肝細胞癌患者(レシピエント)が約千万円ドナーに約2百万円かかりますが、2005年4月以来ミラノ基準を満たす症例に限り、共に健保が適応となりました。このように手厚い医療保護を受けられるのは日本だけですので、肝細胞癌の生体肝移植症例はこれから増加し続けるでしょう。しかし生体肝移植に伴ういくつもの重要な問題点があります。一つは「自分の肝臓の一部を患者さんに提供したい」という尊い意志を持つ、一定年齢以下のドナーが確保できる条件で、殆どが親族か配偶者です。日本では0.03%と非常に少ないのですが、ドナーが死亡する危険性はゼロではありません。外国では0.1%〜1.0%と見積もられていますし、肝臓を提供した後に加療を必要とする後遺症を発症するドナーも、20%位はいると云われています。
ドナーの心理的および精神的負担について、日本では研究成績が殆ど発表されていませんが、外国ではよく調べられています。愛する人(loved one)の寿命を例え5年生存率が50%だとしても自分の肝臓を一部分提供することで延ばせるなら喜んで、と考える博愛者が殆どのようです。ほとんどのドナーが、術後1年には一般人と同等な生活に戻れます。術後の成績が期待通りにいかなかった場合ですら「肝臓をあげてよかった」と考えるドナーが多く、「もう一度提供してもよい」と考える方々も9割以上います。また、ドナーの殆どが、自分で肝臓提供の決意を固めておられますから、危険性を十分に説明した上での術前同意書(インフォームドコンセント)には全く意味がない、とすらいわれています。一方、もともとドナーの義務感が強いので、勿論のこと「強制は厳に慎むべき」とされています。
肝細胞癌の生体肝移植療法とミラノ基準
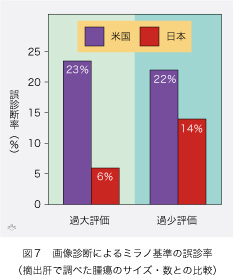 条件が整って生体肝移植のドナーが得られる幸せな肝細胞癌症例は、決して多くありませし、その場合にも「ミラノ基準」という大きな壁があります。「単独癌なら直径5センチ以下、多発癌なら直径3センチ以下が3個まで」の条件を満たさないと多額の医療費が全額自己負担になってしまいます。しかしミラノ基準は絶対基準ではなく、統計に基づく相対的な目安ですから、患者さんによってはそれを超えても、生命予後が良い方々も大勢います。多数の患者さんが順番待ちしている死体肝移植と違い生体肝移植の対象は唯一人で競合がありません。そのために生体肝移植にはミラノ基準を適用しない主義の医者もいます。ミラノ基準の適用は術前に画像診断で決める以外ありませんが、摘出肝の病理診断と比較すると(図7)、米国の成績では、20%以上の過大評価と過小評価があります。 世界一の画像診断技術を誇る日本ですら、米国ほどひどくはありませんが、過大および過小評価なしとはしません(それぞれ6%と14%もあります)。適合基準であると同時に除外要項でもある「ミラノ基準」を、生体肝移植に適用するのは、いささかの弊害があります。一つは腫瘍がある大きさに成長するまで、待っていなければならないことです。その間に肝細胞癌が進行し、血管とリンパ管内に浸潤して他臓器とリンパ節にも転移する危険性が増加する可能性があります。その上、この間にドナー候補が歳をとって年齢制限を超えてしまうこともあり得ます。何とかしてミラノ基準に合致させる目的で、あらかじめ局所療法によって直径5センチ以上の腫瘍を排除し、直径3センチ以下の数も3個以下に納めてしまう姑息的な対策もすら助長しかねません。しかし、これもに時間がかかりますので、根治療法のタイミングを逃してしまう危険を伴います。
条件が整って生体肝移植のドナーが得られる幸せな肝細胞癌症例は、決して多くありませし、その場合にも「ミラノ基準」という大きな壁があります。「単独癌なら直径5センチ以下、多発癌なら直径3センチ以下が3個まで」の条件を満たさないと多額の医療費が全額自己負担になってしまいます。しかしミラノ基準は絶対基準ではなく、統計に基づく相対的な目安ですから、患者さんによってはそれを超えても、生命予後が良い方々も大勢います。多数の患者さんが順番待ちしている死体肝移植と違い生体肝移植の対象は唯一人で競合がありません。そのために生体肝移植にはミラノ基準を適用しない主義の医者もいます。ミラノ基準の適用は術前に画像診断で決める以外ありませんが、摘出肝の病理診断と比較すると(図7)、米国の成績では、20%以上の過大評価と過小評価があります。 世界一の画像診断技術を誇る日本ですら、米国ほどひどくはありませんが、過大および過小評価なしとはしません(それぞれ6%と14%もあります)。適合基準であると同時に除外要項でもある「ミラノ基準」を、生体肝移植に適用するのは、いささかの弊害があります。一つは腫瘍がある大きさに成長するまで、待っていなければならないことです。その間に肝細胞癌が進行し、血管とリンパ管内に浸潤して他臓器とリンパ節にも転移する危険性が増加する可能性があります。その上、この間にドナー候補が歳をとって年齢制限を超えてしまうこともあり得ます。何とかしてミラノ基準に合致させる目的で、あらかじめ局所療法によって直径5センチ以上の腫瘍を排除し、直径3センチ以下の数も3個以下に納めてしまう姑息的な対策もすら助長しかねません。しかし、これもに時間がかかりますので、根治療法のタイミングを逃してしまう危険を伴います。
命を担保に入れてまで自分の肝臓を一部提供して下さるドナーがおられることは患者冥利に尽きますし、そうある話ではありません。ミラノ基準が、絶対則でないかぎり、杓子定規にこれを生体肝移植に当てはめて、それを満たすため術前に工夫をこらすやり方は、決して健全とは云えません。その上、画像診断技術が向上するにつれ、直径3センチ以下の肝細胞癌がもっと見つかるようになる筈です。除外事項がない肝細胞癌症例は、もともと数が限られますし、生体肝移植の健保適応を拡大することが検討されてもよいのではないでしょうか。生体肝移植が、唯ひとつの肝細胞癌根治手術である以上、その適否を決定することは、患者さんの生死を決める結果となります。例外が多く「結果は神のみぞ知る」のであれば、生体肝移植にミラノ基準を絶対適応することは、人間が判断できる枠を、大幅に超えてしまうことになるのではないでしょうか?![]()